第五章分子结构
第五章 分子结构

化学键:分子或晶体中相邻原子 间的强烈作用力。 (离子键,共价键,金属键) 分子空间构型:分子在空间呈现 定的几何构型。 分子问作用力:范德华力 氢键
化 学 键: 分子或晶体中相邻原子 间的强烈作用力。 (离子键,共价键,金属键) 分子空间构型: 分子在空间呈现 一定 的几何构型。 分子间作用力: 范德华力 氢键

H:H C1:C1 NiiN
早期共价键理论是路易斯的共用电子对 理论。即:原子间靠共用电子对结合起来 的化学键是共价键。如: 各原子满足稀有气体的稳定结构。但是: 像PCl5 : 和SF6 : 是没有稀有气体的稳定结构的

兼 兼 现代价键理论VB法 分子轨道理论MO法
1927年,海特勒、伦敦解 H2分子的薛定谔方程,共 价键的本质才得以解释。 目前共价键理论有: 现代价键理论(VB法) 分子轨道理论(MO法)

5.1现代价键理论VB法 51.1共价键的本质 氢分子的形成: 未成对电子
5.1现代价键理论——VB法 氢分子的形成: 解氢分子的薛定谔方程时得知:两个 氢原子的未成对电子靠近时,系统能量 的变化如图: 5.1.1 共价键的本质

分子形成时的势能变化 0 -436 74p H一H距离
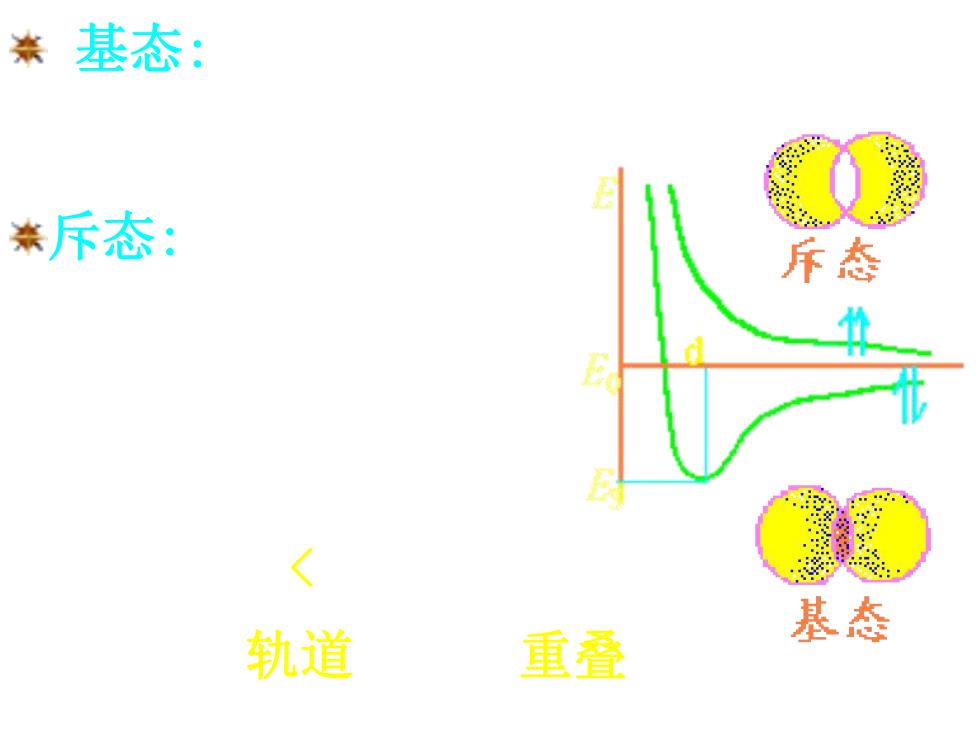
米基态: 斥态: 斥态 < 轨道 重叠 基态
基态:电子自旋相反, 引力增强,能量降低。 基态时,d=74pm, Es =-436kJ·mol-1 。 74pm < 2a0=106pm 说明原子轨道发生了重叠。 斥态:电子自旋平行, 斥力增强,系统能量高

共价键的本质: 。形成条件:成键的两原子均 含有单电子,且自旋方向相反 ·电子配对的实质是:成键电子原子轨道 的重叠核间电子云密集,系统能量降低 兼共价键的本质:是电性的
共价键的本质: 形成条件: 成键的两原子均 含有单电子,且自旋方向相反 电子配对的实质是:成键电子原子轨道 的重叠.核间电子云密集,系统能量降低 共价键的本质:是电性的

5.1.2现代价键理论要点: *自旋方向相反的成单电子 靠近时,可以形成稳定的共价键 共价键具有饱和性:电子配对后不再 与第三个电子成键 轨道最大重叠原理:成键原子的原子 轨道重叠程度越大,键越牢。(共价键 具有方向性) HCI分子形成
5.1.2 现代价键理论要点: 自旋方向相反的成单电子 靠近时,可以形成稳定的共价键. 轨道最大重叠原理:成键原子的原子 轨道重叠程度越大,键越牢。(共价键 具有方向性) 共价键具有饱和性:电子配对后不再 与第三个电子成键 HCl分子形成 - + + - + + - + +
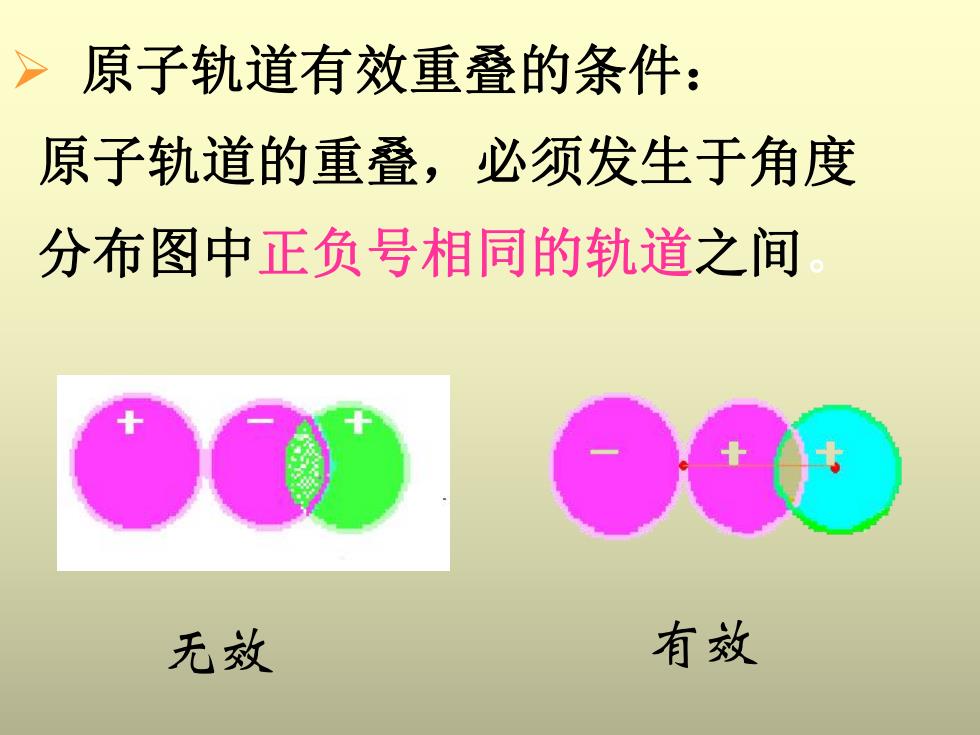
>原子轨道有效重叠的条件: 原子轨道的重叠,必须发生于角度 分布图中正负号相同的轨道之间 无效 有效
Ø 原子轨道有效重叠的条件: 原子轨道的重叠,必须发生于角度 分布图中正负号相同的轨道之间。 无效 有效