
例3写出所给基态原子的电子排布式 22T1 1s22s223s233d43 80 1s2252p 26Fe1s22s22p63s23p63b4s2 29Cu1s22s22p63s23p63d04s1
例3 写出所给基态原子的电子排布式 22Ti 1s 2s 2p 3s 3p 3d 4s 26Fe 1s2 2s2 2p6 3s2 3p6 29Cu 1s2 2s2 2p6 3s2 3p6 3d10 2 2 6 2 6 2 2 3d6 4s1 8O 1s2 2s2 2p4 4s2

原子的“外层电子构型 22Ti1s22s22p63s23p6 3d24s2 原子实【Ar]外层电子构型 电子排布式可写为:[Ar]3d24s2 24Cr 1s22s22p63s23p63d54s1 电子排布式可写为:[Ar]3d54s1 11Na1s22s22p63s1 电子排布式可写为:Ne13s
➢原子的“外层电子构型” 22Ti 1s2 2s2 2p6 3s2 3p6 3d2 4s2 原子实 [Ar] 外层电子构型 电子排布式可写为:[Ar]3d2 4s2 24Cr 1s2 2s2 2p6 3s2 3p6 3d5 4s1 电子排布式可写为:[Ar]3d5 4s1 11Na 1s2 2s2 2p6 3s1 电子排布式可写为:[Ne]3s1
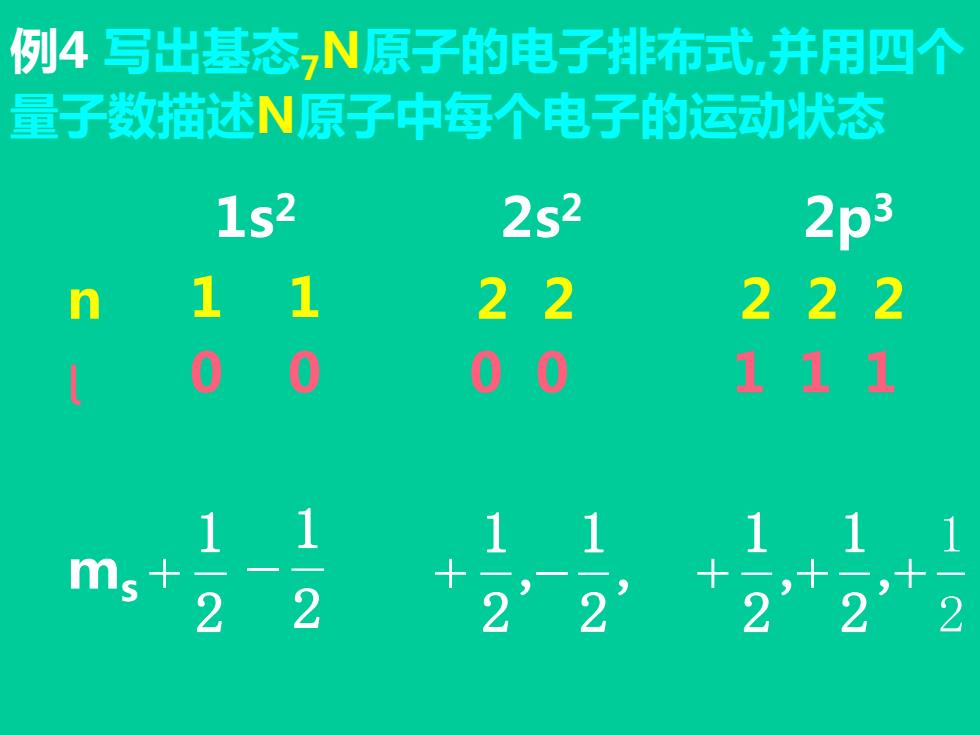
例4写出基态,N原子的电子排布式,并用四个 量子数描述N原子中每个电子的运动状态 1s2 2s2 2p3 n 1 1 22 222 0 0 00 111 ms 2 2
例4 写出基态7N原子的电子排布式,并用四个 量子数描述N原子中每个电子的运动状态 2 1 + 1s2 , 2 1 , 2 1 + − 2 1 + + ,+ 2 1 , 2 1 2s2 2p3 0 0 0 0 1 -1 ms 0 0 0 1 1 1 m l n 1 1 2 2 2 2 2 0 0 2 1 −

同理,次外电子层(n-1)的第19个电子 是这样填入的: (n-1)s2(n-1)p6(n-1)d10(n-1)f14 但是(n-1)f能级高于n+1)s能级,此电 子必定是(n+1)s1。此时n-1已不是次 外层而是外数第三层了
(n-1)s2 (n-1)p6 (n-1)d10(n-1)f14 但是(n-1)f能级高于(n+1)s能级,此电 子必定是(n+1)s1。此时n-1已不是次 外层而是外数第三层了。 同理,次外电子层(n-1)的第19个电子 是这样填入的:

例题:简单说明:为什么最外电子层的电 子数不能超过8个,次外电子层的电子数 不能超过18个? 解:在最外电子层(n),8个电子是:ns2np6 若有第9个电子应是nd1。由于能级交错 nd能级高于(n+1)s能级.所以此电子必定 填为(n+1)s1。此时,n层已不是最外电 层了
例题:简单说明:为什么最外电子层的电 子数不能超过8个,次外电子层的电子数 不能超过18个? 32 解:在最外电子层(n),8个电子是:ns2 np6 若有第9个电子应是nd1。由于能级交错, nd能级高于(n+1)s能级.所以此电子必定 填为(n+1)s1。此时,n层已不是最外电子 层了

周期系中各元素原子核外电子的分布 1s1 1s2 2s1 3s1 4s13d1-10 5s14d1-10 6s15d14f1-14 5d10 6 7s16d151-146d2-7(未完)
周期系中各元素原子核外电子的分布 1s1—————————————— 1s2 2s1—————————————— 2p6 3s1—————————————— 3p6 4s1—3d1-10———————————4p6 5s1—4d1-10———————————5p6 6s1—5d1——4f1-14——5d10———— 6p 7s1—6d1——5f1-14——6d2-7 (未完)