
亲近似能级图 6D00 5d00000 鲍林轨道近以能级 4f0000000 6s0 给出多电子原子 D000 4d00oo0 5s0 轨道近似能级图 4p000 3d00000 >氢原子:车 4s0 由n来决 s0 2p000 >多电子原子: 250 s0 能级由n、t快足
近似能级图 氢原子:轨道能级 由n来决定 多电子原子:轨道 能级由n、l决定 鲍林轨道近似能级 给出多电子原子 轨道近似能级图 E 1s o 2p ooo 2s o 3p ooo 3s o 4p ooo 3d ooooo 4s o 5p ooo 4d ooooo 5s o 6p ooo 5d ooooo 4f ooooooo 6s o

6D000 5d ooooo 4f0000000 6s0 5p000 4d00000 5s0 4po0 3d00000 4s0 3p000 3s0 2D000 2s0 lso
E 1s o 2p ooo 2s o 3p ooo 3s o 4p ooo 3d ooooo 4s o 5p ooo 4d ooooo 5s o 6p ooo 5d ooooo 4f ooooooo 6s o
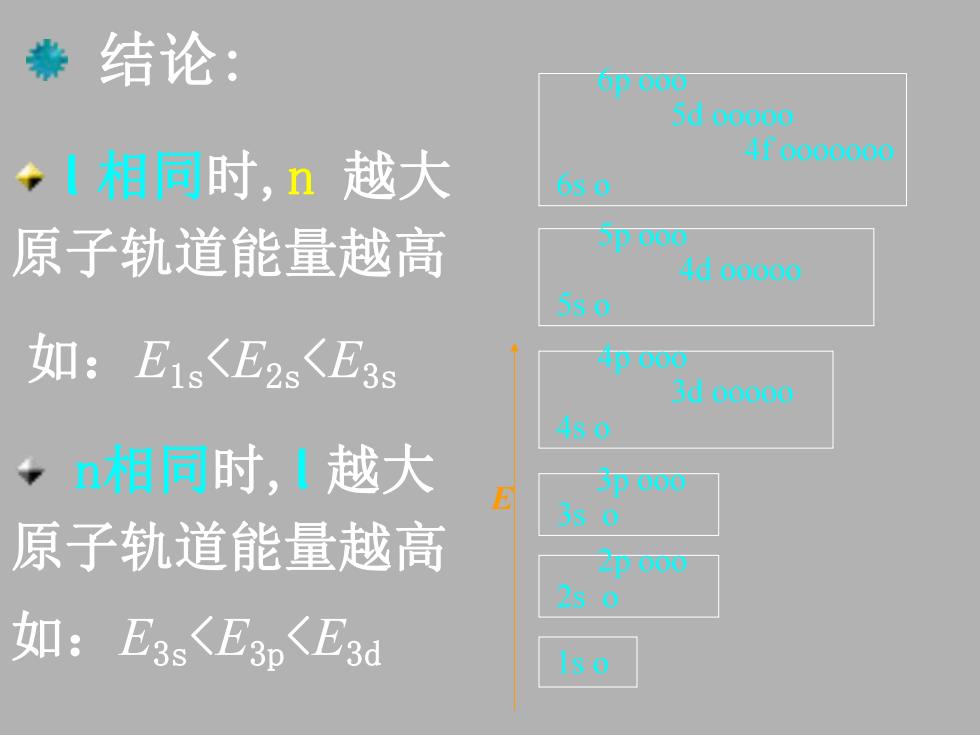
◆结论: 5d00000 ◆相同时,n越大 4f0000000 6s0 原子轨道能量越高 D000 4d00oo0 5s0 如:E1s〈E2s〈E3s 4p000 3d00000 4s0 ◆n相同时,【越大 5D000 s0 原子轨道能量越高 Zp000 250 如:E3s<E3n<E3d s0
结论: l 相同时,n 越大 原子轨道能量越高 n相同时,l 越大 原子轨道能量越高 如:E1s<E2s<E3s 如:E3s<E3p<E3d E 1s o 2p ooo 2s o 3p ooo 3s o 4p ooo 3d ooooo 4s o 5p ooo 4d ooooo 5s o 6p ooo 5d ooooo 4f ooooooo 6s o

n、I皆不同时,某些n值较大的轨道 的能量可能低于值较小的轨道能量 称为“能级交错”现象.如: E4s<E3d E6s<E4t<E5d ◆n、皆相同时,原子轨道的能量相等, 如: E2pxE2ny-B2pz
n、l皆不同时,某些n值较大的轨道 的能量可能低于n值较小的轨道能量 称为“能级交错”现象.如: E4s<E3d E6s<E4f<E5d n、l皆相同时,原子轨道的能量相等, 如: E2px =E2py =E2pz

⑦ 徐光宪规则 能领组 6D000 6.7 5doooo0 6.4 用(n+0.7)值衡 4f0000000 6.1 6s0 6.0 量轨道能量的高 D000 5.7 4d00oo0 5.4 低。 5s0 5.0 D000 4.7 n+0.7值首数 3d00000 4.4 4s0 4.0 相同的能级为同 3.7 E 5D000 3.0 能级组 是划分同期 D000 2.7 2S0 2.0 的依据 1s0 1.0
用(n+0.7l)值衡 量轨道能量的高 低。 徐光宪规则 e E 1s o 1.0 Ⅰ 2p ooo 2.7 2s o 2.0 Ⅱ 3p ooo 3.7 3s o 3.0 Ⅲ 4p ooo 4.7 3d ooooo 4.4 4s o 4.0 Ⅳ 5p ooo 5.7 4d ooooo 5.4 5s o 5.0 Ⅴ 6p ooo 6.7 5d ooooo 6.4 4f ooooooo 6.1 6s o 6.0 Ⅵ 能级组 (n+0.7l)值首位数 相同的能级为同一 能级组,是划分周期 的依据

0p000 6.7 5d0ooo0 6.4 4f00000006.1 650 6.0 5p0o0 5.7 4do0000 5.4 5s0 5.0 4p0o0 4.7 3d000004.4 450 4.0 p000 3.7 350 3.0 2p000 2.7 280 2.0 1s0 1.0
1s o 1.0 Ⅰ 2p ooo 2.7 2s o 2.0 Ⅱ 3p ooo 3.7 3s o 3.0 4p ooo 4.7 3d ooooo 4.4 4s o 4.0 Ⅳ 5p ooo 5.7 4d ooooo 5.4 5s o 5.0 6p ooo 6.7 5d ooooo 6.4 4f ooooooo 6.1 6s o 6.0 Ⅵ

4.3.2核外电子的排布规律 (多电子原子中电子填充规律) >泡利不相容原理同一原子中,不可 能有四个量子数完全相同的两个电子。 即一个原子轨道最多只能容纳两个自旋方向 相反的电子。 能量最低原理: 基态原子中,在不违背 泡利不相容原理的前提下,电子总是尽先占据 能量最低的原子轨道,使原子的能量最低
4.3.2 核外电子的排布规律 泡利不相容原理:同一原子中,不可 能有四个量子数完全相同的两个电子。 即一个原子轨道最多只能容纳两个自旋方向 相反的电子。 (多电子原子中电子填充规律) 能量最低原理:基态原子中,在不违背 泡利不相容原理的前提下,电子总是尽先占据 能量最低的原子轨道,使原子的能量最低

>洪特规则:简并轨道上的电子,将 尽先分占不同轨道而且自旋平行。 简并轨道在处于全满(s2,p6,d10,f14)、 半满(s1,p3,d5,f7)、全空(s,p,d9,f) 时系统较稳定。 例如:送的电排布式为 1s22%oe3s28093d54s1 注意:多数原子电子排布特合这三规律
洪特规则:简并轨道上的电子,将 尽先分占不同轨道而且自旋平行。 简并轨道在处于全满(s 2 ,p 6 ,d 10 ,f 14)、 半满(s 1 ,p 3 ,d 5 ,f 7)、全空(s 0 ,p 0 ,d 0 ,f 0) 时系统较稳定。 例如: 24Cr 的电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 注意: 多数原子电子排布符合这三规律