
4.2波函数与原子轨道 薛定谔方程(电子波动方程): ∂2功0功∂2b.1 nm (E-b=0 解此方程可得:①系统的能量E: ②波函数亚(x,y,Z)。 9
4.2 波函数与原子轨道 薛定谔方程(电子波动方程): 0 πm 2 2 2 ψ z h ψ y ψ ψ 2 ( ) 8 2 2 2 2 E V x 解此方程可得:①系统的能量E ; ②波函数ψ(x,y,z)。 9 第二节 核外电子运动状态的描述

Ψ。1,(x,y,z)是描述电子运动状态 的数学函数式。平又称原子轨道。 >注意:这里的原子轨道与玻尔的圆形轨迹不同 解此方程时自然引入三个量子数:n、 1、m。 只有它们取合理组合,Ψ1, 才有合理解,外加m就可以描述核 外电子的运动状态。 10
解此方程时自然引入三个量子数:n、 l、m。 只有它们取合理组合,Ψn,l,m 才有合理解,外加 ms 就可以描述核 外电子的运动状态。 10 Ψ 又称原子轨道。 Ψn,l,m(x,y,z)是描述电子运动状态 的数学函数式。 Ø 注意: 这里的原子轨道与玻尔的圆形轨迹不同

⊕量子数及其物理意义 (一)主量子数(n) ◆物理意义:1.表示电子在核外空间出现的 概率的最大区域离核的远近 2.是决定电子能量的主要因素 ◆取值 n=12345..(电子层) ◆光谱学特号KL MNO P ◆特例:单电子系统的电子能量完全由决定 1
量子数及其物理意义 取 值 n = 1 2 3 4 5 …(电子层) (一) 主量子数(n) 光谱学符号 K L M N O P 物理意义: 1. 表示电子在核外空间出现的 概率的最大区域离核的远近 2. 是决定电子能量的主要因素 11 特例:单电子系统的电子能量完全由n决定 11

(二)角量子数() ◇物理意义:1.决定原子轨道的形状 2.在多电子原子中是决定电子 能量的又一因素 ◆取值 1=0123.(n-1)(电子亚层) ◇光谱学符号s p d f g ◆形状 球双球花辨 ◆n相同【不同:Es<Ep<Ed<Ef 12
12 (二) 角量子数 ( l ) 物理意义: 1. 决定原子轨道的形状 2. 在多电子原子中是决定电子 能量的又一因素 取值 l = 0 1 2 3 …(n-1) (电子亚层) 光谱学符号 s p d f g 形状 球 双球 花瓣 n 相同 l 不同 : Ens< Enp < E nd < E nf

(三)磁量子数(m) “物理意义:决定原子轨道在空间的伸展方向 出取值 m=0,士1,士2..士 共2+1)个 如p亚层三个原子 轨道的三个伸展 方向。 13
(三) 磁量子数 (m) 13 如p亚层三个原子 轨道的三个伸展 方向。 物理意义: 决定原子轨道在空间的伸展方向 取值 : m= 0,±1,±2…±l 共(2l+1)个
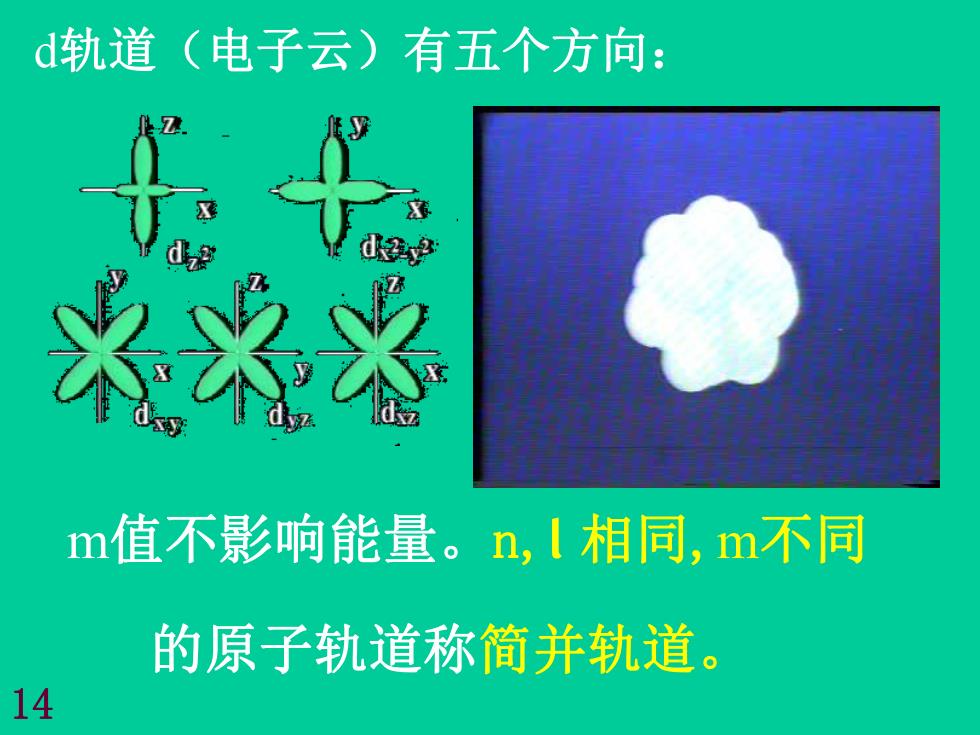
d轨道(电子云)有五个方向: d超 米洛※ m值不影响能量。n,1相同,m不同 的原子轨道称简并轨道。 14
m值不影响能量。n,l 相同,m不同 的原子轨道称简并轨道。 14 d轨道(电子云)有五个方向:

简并轨道数: l=1m=0,士1p亚层有3条 l=2m=0,士1,±2 d亚层有5条 l=3m=0,士1,±2,±3 f亚层有7条
简并轨道数: l = 1 m = 0, ±1 p 亚层有 3 条 l = 2 m = 0, ±1, ±2 d 亚层有 5 条 l = 3 m = 0, ±1, ±2, ±3 f 亚层有 7 条