
实验一动物性食品微生物学检验 [实验目的]掌握动物性食品中菌落总数、大肠菌群测定和沙门氏菌检验的程序、操作 步骤和结果报告,熟悉检测项目的基本原理及卫生学意义。 一、动物性食品中菌落总数的测定 菌落总数(Aerobic plate coun)是指食品检样经过处理,在一定条件下(如培养基 培养温度和培养时间等)培养后,所得每g(mL)检样中形成的微生物菌落总数。菌落计 数以菌落形成单位(colony-forming units,CFU)表示。 每种细菌都有它一定的生理特性,培养时,应用不同的营养条件及其它生理条件(如 温度,培养时间, ,需氧性质等)去满足其需求 才能分别将各种细都培养出来, 实际工作 中,菌落 是以检 细 和平权 数琼脂混 在37C有 条件下培养,米测定样品中的菌落总数,所得结果只包括一群在平板计数琼脂中发育的嗜 中温性需氧和兼性厌氧细菌的菌落总数。 菌落总数的增多和食品的变质常有一定的联系,但和食品安全性不一定相关。菌落总数 主要是作为判定食品被细菌污染程度的标记,也可以应用这一方法观察食品中细菌的性质以 及细菌在食品中繁殖的动态,以便对被检样品进行卫生学评价时提供 学低 。木实哈中 落总数测定按GB4789,2一2010《食品安全国家标准食品微生物学检验菌落总数测定》进 行。 1.设备和材料除微生物实验室常规灭南及培养设备外,其他设备和材料如下: (1)恒温培养箱36C±1℃,30℃±1℃。 (2)冰箱.2℃5℃ (3)恒温水浴箱:46C±1℃。 (4)天平:感量为0.1g (5)均质器或灭菌乳体。 (6)振荡器。 7)无菌吸管:1mL(具0.01mL刻度)、10ml(具0.1ml刻度)或微量移液器 及吸头 (8)无菌锥形瓶:容量250mL、500mL。 (9)无菌培养皿:直径90mm。 (1O)pH计或pH比色管或精密pH试纸。 (11)放大镜或/和菌落计数器。 (12)灭菌刀、剪子 (13)放大镜或/和菌落计数器。 (14)灭菌玻璃珠:直径为5mm。 2.培养基和试剂 (1)平板计数琼脂培养基 ①成分:胰蛋白胨5.0g,酵母浸膏2.5g,葡萄糖1.0g,琼脂15.0g,蒸馏水1000 mL, H70402 ②制法:将上述成分加于蒸馏水中,煮沸溶解,调节H。分装试管或锥形瓶,121℃ 高压灭菌15min
实验一 动物性食品微生物学检验 [实验目的] 掌握动物性食品中菌落总数、大肠菌群测定和沙门氏菌检验的程序、操作 步骤和结果报告,熟悉检测项目的基本原理及卫生学意义。 一、动物性食品中菌落总数的测定 菌落总数(Aerobic plate count)是指食品检样经过处理,在一定条件下(如培养基、 培养温度和培养时间等)培养后,所得每g(mL)检样中形成的微生物菌落总数。菌落计 数以菌落形成单位(colony-forming units,CFU)表示。 每种细菌都有它一定的生理特性,培养时,应用不同的营养条件及其它生理条件(如 温度,培养时间,pH,需氧性质等)去满足其需求,才能分别将各种细菌都培养出来。但 实际工作中,菌落总数测定,是以检样中的细菌细胞和平板计数琼脂混合后,在 37℃有氧 条件下培养,来测定样品中的菌落总数,所得结果只包括一群在平板计数琼脂中发育的嗜 中温性需氧和兼性厌氧细菌的菌落总数。 菌落总数的增多和食品的变质常有一定的联系,但和食品安全性不一定相关。菌落总数 主要是作为判定食品被细菌污染程度的标记,也可以应用这一方法观察食品中细菌的性质以 及细菌在食品中繁殖的动态,以便对被检样品进行卫生学评价时提供科学依据。本实验中菌 落总数测定按 GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》进 行。 1. 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: (1)恒温培养箱 36℃±1℃,30℃±1℃。 (2)冰箱:2℃~5℃。 (3)恒温水浴箱:46℃±1℃。 (4)天平:感量为0.1 g。 (5)均质器或灭菌乳钵。 (6)振荡器。 (7)无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器 及吸头。 (8)无菌锥形瓶:容量250 mL、500 mL。 (9)无菌培养皿:直径90 mm。 (10)pH计或pH比色管或精密pH试纸。 (11)放大镜或/和菌落计数器。 (12)灭菌刀、剪子、镊子等。 (13)放大镜或/和菌落计数器。 (14)灭菌玻璃珠:直径为 5 mm。 2. 培养基和试剂 (1)平板计数琼脂培养基 ① 成分:胰蛋白胨5.0 g,酵母浸膏2.5 g,葡萄糖1.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 7.0±0.2。 ② 制法:将上述成分加于蒸馏水中,煮沸溶解,调节pH。分装试管或锥形瓶,121℃ 高压灭菌15 min
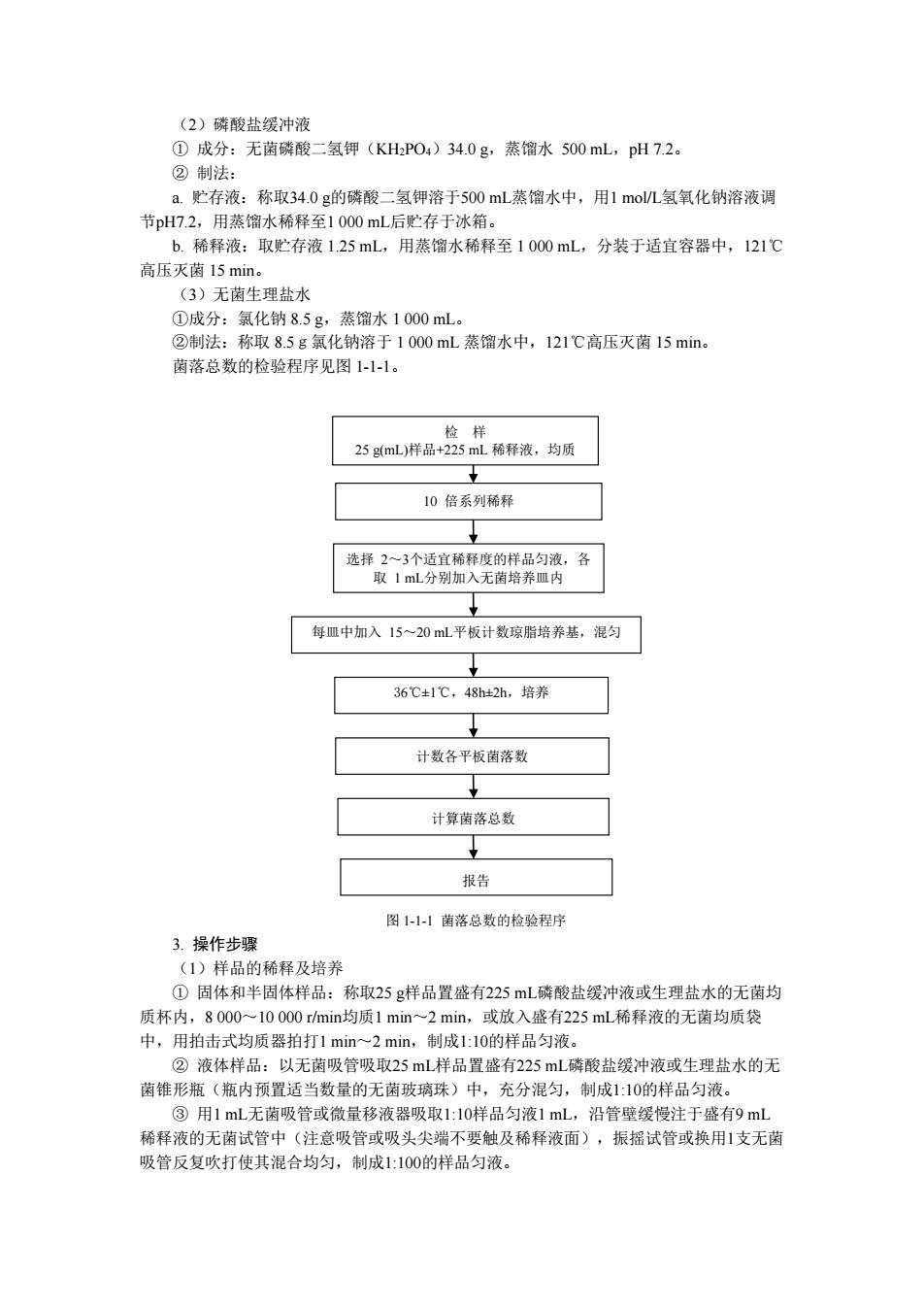
(2)磷酸盐缓冲液 ①成分:无菌磷酸二氢钾(KHPO4)34.0g,蒸馏水500mL,pH7.2。 ②制法 a.贮存液:称取34.0g的磷酸二氢钾溶于500mL蒸馏水中,用1molL氢氧化钠溶液调 节pH7.2,用蒸馏水稀释至1000mL后贮存于冰箱。 b.稀释液:取贮存液1.25mL,用蒸馏水稀释至1000mL,分装于适宜容器中,121℃ 高压灭菌15min (3)无菌生理盐水 ①成分:氯化钠85g,蒸馏水1000mL。 2制法:称取8.5g氯化钠溶于1000mL蒸馏水中,121℃高压灭菌15min。 菌落总数的检验程序见图111。 稀释液,均质 10倍系列稀释 每皿中加入15~20ml平板计数琼脂培养基,混匀 36℃1℃,48h2h,培养 计数各平板菌落数 计算菌落总数 报告 图1-1-1荫落总数的检验程序 3.操作步骤 (1)样品的稀释及培养 ①固体和半固体样品:称取25g样品置盛有25mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8000~10000 r/min均质1min~2min,或放入盛有225ml稀释液的无菌均质袋 中,用拍击式均质器拍打1min~2min,制成1:10的样品匀液。 ②液体样品:以无南吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无 菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9ml 稀释液的无菌试管 (注意吸管或吸头 端不 要触及稀释液面),振据试管或换用1支无菌 吸管反复吹打使其混合均匀,制成1:100的样品匀液
(2)磷酸盐缓冲液 ① 成分:无菌磷酸二氢钾(KH2PO4)34.0 g,蒸馏水 500 mL,pH 7.2。 ② 制法: a. 贮存液:称取34.0 g的磷酸二氢钾溶于500 mL蒸馏水中,用1 mol/L氢氧化钠溶液调 节pH7.2,用蒸馏水稀释至1 000 mL后贮存于冰箱。 b. 稀释液:取贮存液 1.25 mL,用蒸馏水稀释至 1 000 mL,分装于适宜容器中,121℃ 高压灭菌 15 min。 (3)无菌生理盐水 ①成分:氯化钠 8.5 g,蒸馏水 1 000 mL。 ②制法:称取 8.5g氯化钠溶于 1 000 mL 蒸馏水中,121℃高压灭菌 15 min。 菌落总数的检验程序见图 1-1-1。 图 1-1-1 菌落总数的检验程序 3. 操作步骤 (1)样品的稀释及培养 ① 固体和半固体样品:称取25 g样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8 000~10 000 r/min均质1 min~2 min,或放入盛有225 mL稀释液的无菌均质袋 中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 ② 液体样品:以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液或生理盐水的无 菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③ 用1 mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于盛有9 mL 稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌 吸管反复吹打使其混合均匀,制成1:100的样品匀液。 选择 2~3个适宜稀释度的样品匀液,各 取 1 mL分别加入无菌培养皿内 每皿中加入 15~20 mL平板计数琼脂培养基,混匀 36℃±1℃,48h±2h,培养 计数各平板菌落数 计算菌落总数 报告 检 样 25 g(mL)样品+225 mL 稀释液,均质 10 倍系列稀释

④另取1mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增 稀释一次,换用1次1L无菌吸管或吸头。 ⑤根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包 括原液),在进行10倍递增稀释时, 吸取1mL样品匀液于无菌平皿内,每个稀释度做两个 平皿。同时,分别吸取1mL空白稀释液加入两个无菌平皿内作空白对照。 ®稀释液移入平皿后,及时将15mL~20mL冷却至46℃的平板计数琼脂培养基(可 放置于46℃±1℃恒温水浴箱中保温)领注平皿,并转动平皿使其混合均匀。 ⑦待琼脂凝固后,将平板翻转,36℃±1℃培养48ht2h。水产品30℃±1℃培养 72ht3h。如果样品中 可能含有在琼脂培养基表面弥漫生长的菌落时 可在凝固后的琼脂表 面覆盖一薄层琼脂培养基(约4mL),凝固后翻转平板,进行培养 (2)菌落计数可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应 的菌落数量。 ①洗取菌落数在30CFU一300CF之间、无莓征菌落生长的平板计数菌落总数。低于 30C℉U的平板记录具体菌落数,大于300C℉U的可记录为多不可计。每个稀释度的菌落数 应采用两个平板的平均数 ②其中 个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板 作为该稀释度的菌落数:若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀, 即可计算半个平板后乘以2,代表一个平板菌落数。 ③当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。 (3)结果与报生 ①菌落总数的计算方法 a.若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均 值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果(表1-1-2中例 b.若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1-1-1)计算 N= (1-1-1) (n +0.In,d 式中: 一样品中南落数 EC- 平板(含适宜范围菌落数的平板)菌落数之和 稀释度(低稀释倍数)平板个数: 第二稀释度(高稀释倍数)平板个数: d一稀释因子(第一稀释度)。 表111两个连续稀释度的平板菌落数在适宜计数范围内时的示例 稀释度 1:100(第一稀释度) 1:1000(第二稀释度) 菌落数(CFU) 232,244 33,35 232+244+33+35 = 544 =24727 2+0.1×2102 0.022 上述数据修约后,表示为25000或2.5×10。 c.若所有稀释度的平板上茵落数均大于300C℉U,则对稀释度最高的平板进行计数, 其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算(表1-12中例 2)
④ 另取1 mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增 稀释一次,换用1次1 mL无菌吸管或吸头。 ⑤ 根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包 括原液),在进行10倍递增稀释时,吸取1 mL样品匀液于无菌平皿内,每个稀释度做两个 平皿。同时,分别吸取1 mL空白稀释液加入两个无菌平皿内作空白对照。 ⑥ 稀释液移入平皿后,及时将15 mL~20 mL冷却至46℃的平板计数琼脂培养基(可 放置于46℃±1℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。 ⑦ 待琼脂凝固后,将平板翻转,36℃±1℃培养 48h±2 h。水产品 30℃±1℃培养 72h±3 h。如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表 面覆盖一薄层琼脂培养基(约4 mL),凝固后翻转平板,进行培养。 (2)菌落计数 可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应 的菌落数量。 ① 选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数菌落总数。低于 30 CFU的平板记录具体菌落数,大于300 CFU的可记录为多不可计。每个稀释度的菌落数 应采用两个平板的平均数。 ② 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板 作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀, 即可计算半个平板后乘以2,代表一个平板菌落数。 ③ 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。 (3)结果与报告 ① 菌落总数的计算方法 a. 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均 值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果(表1-1-2中例 1)。 b. 若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1-1-1)计算: n n d C N 1 2 0.1 (1-1-1) 式中:N——样品中菌落数; ∑C——平板(含适宜范围菌落数的平板)菌落数之和; n1——第一稀释度(低稀释倍数)平板个数; n2——第二稀释度(高稀释倍数)平板个数; d——稀释因子(第一稀释度)。 表 1-1-1 两个连续稀释度的平板菌落数在适宜计数范围内时的示例 稀释度 1:100(第一稀释度) 1:1000(第二稀释度) 菌落数(CFU) 232,244 33,35 上述数据修约后,表示为 25 000 或 2.5×104。 c. 若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数, 其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算(表1-1-2中例 2)。 N= 232+244+33+35 [2+(0.1×2)]10-2 = 544 0.022 =24727

d.若所有稀释度的平板菌落数均小于30C℉U,则应按稀释度最低的平均菌落数乘以稀 释倍数计算(表12中例3) 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释 倍数计算(表1-12中例4)。 E若所有稀释度的平板菌落数均不在30CFU~300C℉U之间,其中一部分小于30C℉U 或大于300C℉U时,则以最接近30CFU或300C℉U的平均菌落数乘以稀释倍数计算(表1- 1-2中例5)。 ②菌落总数的报告(表112报告方式”栏): a.菌落数小于100C℉U时,按“四舍五入”原则修约,以整数报告。 b.菌落数大于或等于100CFU时,第3位数字采用四舍五入"”原则修约后,取前2位数 字,后面用0代替位数:也可用10的指数形式来表示,按四舍五入”原则修约后,采用两位 有效数字。 c.若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延 d若空白X 照上有菌落生长, 则此次检测结果无效 e.称重取样以CFUg为单位报告,体积取样以CFU/mL为单位报告。 表1-12稀释度选择及菊落数报告方式 稀释液及两平板菌落平均数 例次 10-1 102 103 菌落总数MCFU/g(mL】 报告方式CFU/gmL】 1 多不可计 16d 20 16400 16000或1.6x10 2 多不可计 多不可计 33 313000 310000或3.1×10 27 270 270或2.7x102 4 0 0 <1x10 <10 多不可计 305 12 30500 31000或3.1×10 一、动物件食品中大场菌群的测 大肠菌群(Coliforms)是在一定培养条件下能发酵到糖、产酸产气的需氧和兼性厌氧 革兰氏阴性无芽胞杆菌。大肠菌群不是细菌学上的分类命名,不是指某 种特定的细菌 而是根邦 卫生学方面的要求,提出来的一群与粪便污染有关的细菌,这些细菌在生化及血 清学方面并非完全一致,其定义为,这一群细菌包括埃希氏南属,枸椽酸菌属,肠杆南属 (又叫产气杆菌属,包括阴沟肠杆菌和产气肠杆菌)、克雷伯氏菌属中的一部分和沙门氏菌 属的第Ⅱ亚属(能发酵乳糖)的细菌。 一般认为,大肠菌群都是直接或间接来自人与温血动物的的粪便,从食品中检出大肠 菌群既表示食品曾受到人或 血动物粪便的污染,因此大肠菌群作为粪便污染指标菌而衫 提出米。食品中检出大肠菌群的细菌,表明该食品有粪便污染,既有粪便污染。就可能有 肠道致病菌的存在,因而也就有可能通过污染的食品引起肠道传染病的流行。 GB4789.3一2010《食品安全国家标准食品微生物学检验大肠菌群计数》中规定的食品 大肠菌群计数的方法有大肠菌群MP计数法和大肠菌群平板计数法两种方法,可根据检测 的需要选择采用。 大肠菌群MPN(Most probabl MPN)是指每g(mL)检样内所 含大肠菌群的最可能数(表1-2-1),是基于泊松分布的一种间接计数方法。 注:我国以前的食品卫生国家标准中MPN是指每100g(mL)检样内所含大肠菌群的最可能数 MPN/T1OOg(mL)],因此,在引用食品卫生国家标准时,要注意与食品安全国家标准中的MPNAg(mL)】
d. 若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀 释倍数计算(表1-1-2中例3)。 e. 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释 倍数计算(表1-1-2中例4)。 f.若所有稀释度的平板菌落数均不在30 CFU~300 CFU之间,其中一部分小于30 CFU 或大于 300 CFU时,则以最接近30 CFU或300 CFU的平均菌落数乘以稀释倍数计算(表1- 1-2中例5)。 ② 菌落总数的报告(表1-1-2报告方式”栏): a. 菌落数小于100 CFU时,按“四舍五入”原则修约,以整数报告。 b. 菌落数大于或等于100 CFU时,第3位数字采用“四舍五入”原则修约后,取前2位数 字,后面用0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位 有效数字。 c. 若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。 d. 若空白对照上有菌落生长,则此次检测结果无效。 e. 称重取样以 CFU/g 为单位报告,体积取样以 CFU/mL 为单位报告。 表1-1-2 稀释度选择及菌落数报告方式 例次 稀释液及两平板菌落平均数 菌落总数/[CFU/g(mL)] 报告方式/[CFU/g(mL)] 10-1 10-2 10-3 1 多不可计 164 20 16400 16000或1.6×104 2 多不可计 多不可计 313 313000 310000或3.1×105 3 27 11 5 270 270或2.7×102 4 0 0 0 <1×10 <10 5 多不可计 305 12 30500 31000或3.1×104 二、动物性食品中大肠菌群的测定 大肠菌群(Coliforms)是在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧 革兰氏阴性无芽胞杆菌。大肠菌群不是细菌学上的分类命名,不是指某一种特定的细菌, 而是根据卫生学方面的要求,提出来的一群与粪便污染有关的细菌,这些细菌在生化及血 清学方面并非完全一致,其定义为,这一群细菌包括埃希氏菌属,枸椽酸菌属,肠杆菌属 (又叫产气杆菌属,包括阴沟肠杆菌和产气肠杆菌)、克雷伯氏菌属中的一部分和沙门氏菌 属的第Ⅲ亚属(能发酵乳糖)的细菌。 —般认为,大肠菌群都是直接或间接来自人与温血动物的的粪便,从食品中检出大肠 菌群既表示食品曾受到人或温血动物粪便的污染,因此大肠菌群作为粪便污染指标菌而被 提出来。食品中检出大肠菌群的细菌,表明该食品有粪便污染,既有粪便污染.就可能有 肠道致病菌的存在,因而也就有可能通过污染的食品引起肠道传染病的流行。 GB4789.3—2010《食品安全国家标准 食品微生物学检验 大肠菌群计数》中规定的食品 大肠菌群计数的方法有大肠菌群 MPN 计数法和大肠菌群平板计数法两种方法,可根据检测 的需要选择采用。大肠菌群 MPN(Most probable number,MPN)是指每 g(mL)检样内所 含大肠菌群的最可能数(表 1-2-1),是基于泊松分布的一种间接计数方法。 注:我国以前的食品卫生国家标准中 MPN 是指每 100g(mL)检样内所含大肠菌群的最可能数 MPN/[100g(mL)],因此,在引用食品卫生国家标准时,要注意与食品安全国家标准中的 MPN/[g(mL)]

相区别。 1.设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: (1)恒温培养箱:36C±1℃。 (2)冰箱:20 ~5℃ (3)恒温水浴箱:46C±1℃ (4)天平:感量为0.1g。 (5)均质器。 (6)拒熙 (7)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及 吸头。 (8)无菌维形瓶:容量250mL、500mL (9)无菌培养皿:直径90mm。 (10)灭菌玻璃珠:直径为5mm (1)pH计或H比色管或精密pH试纸 (12)灭菌刀、剪子、镊子等 (13)菌落计数器。 2.培养基和试剂 (1)月桂基硫酸盐胰蛋白胨(LST)肉汤 ①成分:蛋白陈或胰酪陈200g,氯化钠50g,乳糖5.0g酸氢二钾(K:HPO,) 275g酸 与细 KH,P04)2.75g,月桂基硫酸钠0.1g,蒸馏水1000ml ②制法:将上述成分溶解于蒸馏水中,调节pH6.8±0.2。分装到有玻璃小倒管的试管 中,每管10mL。121℃高压灭菌15min. (2)煌绿乳糖胆盐(BGLB)肉汤 ①成分:蛋白胨10.0g,乳糖10.0g,牛胆粉(oxgall或oxbile)溶液200mL,0.1%煌 绿水溶液13.3ml 800m ②制法:将蛋白胨、乳糖溶于约500mL蒸馏水中,加入牛胆粉溶液200mL(将20.0g 脱水牛胆粉溶于200mL蒸馏水中,调节pH至7.0~7.5),用蒸馏水稀释到975mL,调节 pH72士0.1,再加入0.1%煌绿水溶液13.3mL,用燕馏水补足到1000mL,用棉花过滤后, 分装到有玻璃小倒管的试管中,每管10mL。121℃高压灭菌15min。 (3)结品紫中性红胆盐琼脂(VRBA) ①成分:蛋白胨7.0g,酵母音3.0g,乳糖10.0g,氯化钠5.0g,胆盐或3号胆盐1.5g, 中性红0.03g,结晶紫0.002g,琼脂15g~18g,蒸馏水1000mL。 ②制法:将上述成分溶于蒸馏水中,静置几分钟,充分搅拌,调节pH7.40.1。煮沸2 mim,将培养基冷却至45C~50℃倾注平板。使用前临时制备,不得超过3h。 (4)磷酸盐缓冲液见菌落总数的测定中磷酸盐缓冲液的配制方法。 (5)无菌生理盐 见菌落总数的测定中无菌生理盐水的配制方法 (6)I mol/L NaOH ①成分:NaOH40.0g,蒸馏水1000mL。 ②制法:称取40.0g氢氧化钠溶于1000mL蒸馏水中,121℃高压灭菌15min。 (7)Imol/LHCI ①成分:浓盐酸90mL,蒸馏水1000m ②制法:移取浓盐酸90mL,用蒸馏水稀释至1000mL,121C高压灭菌15mim。 (8)革兰氏染液 ①结晶紫染色液:结晶紫1.0g,95%乙醇20mL,1%草酸铵水溶液80mL
相区别。 1. 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: (1)恒温培养箱:36℃±1℃。 (2)冰箱:2℃~5℃。 (3)恒温水浴箱:46℃±1℃。 (4)天平:感量为0.1 g。 (5)均质器。 (6)振荡器。 (7)无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及 吸头。 (8)无菌锥形瓶:容量250 mL、500 mL。 (9)无菌培养皿:直径90 mm。 (10)灭菌玻璃珠:直径为5 mm。 (11)pH计或pH比色管或精密pH 试纸。 (12)灭菌刀、剪子、镊子等。 (13)菌落计数器。 2. 培养基和试剂 (1)月桂基硫酸盐胰蛋白胨(LST)肉汤 ① 成分:胰蛋白胨或胰酪胨20.0 g,氯化钠5.0 g,乳糖5.0 g,磷酸氢二钾(K2HPO4) 2.75 g,磷酸二氢钾(KH2PO4)2.75 g,月桂基硫酸钠0.1 g,蒸馏水1 000 mL。 ② 制法:将上述成分溶解于蒸馏水中,调节pH6.8±0.2。分装到有玻璃小倒管的试管 中,每管10 mL。121℃高压灭菌15 min。 (2)煌绿乳糖胆盐(BGLB)肉汤 ① 成分:蛋白胨10.0 g,乳糖10.0 g,牛胆粉(oxgall或oxbile)溶液200 mL,0.1%煌 绿水溶液13.3 mL,蒸馏水800 mL。 ② 制法:将蛋白胨、乳糖溶于约500 mL蒸馏水中,加入牛胆粉溶液200 mL(将20.0 g 脱水牛胆粉溶于200 mL蒸馏水中,调节pH至7.0~7.5),用蒸馏水稀释到975 mL,调节 pH7.2±0.1,再加入0.1%煌绿水溶液13.3 mL,用蒸馏水补足到1 000 mL,用棉花过滤后, 分装到有玻璃小倒管的试管中,每管10 mL。121℃高压灭菌15 min。 (3)结晶紫中性红胆盐琼脂(VRBA) ① 成分:蛋白胨7.0 g,酵母膏3.0 g,乳糖10.0 g,氯化钠5.0 g,胆盐或3号胆盐1.5 g, 中性红0.03 g,结晶紫0.002 g,琼脂 15 g~18 g,蒸馏水1 000 mL。 ② 制法:将上述成分溶于蒸馏水中,静置几分钟,充分搅拌,调节pH 7.4±0.1。煮沸2 min,将培养基冷却至45℃~50℃倾注平板。使用前临时制备,不得超过3 h。 (4)磷酸盐缓冲液 见菌落总数的测定中磷酸盐缓冲液的配制方法。 (5)无菌生理盐水 见菌落总数的测定中无菌生理盐水的配制方法。 (6)1 mol/L NaOH ① 成分:NaOH 40.0 g,蒸馏水1 000 mL。 ② 制法:称取 40.0 g 氢氧化钠溶于 1 000 mL 蒸馏水中,121℃高压灭菌 15 min。 (7)1 mol/LHCl ① 成分:浓盐酸90 mL,蒸馏水1 000 mL ② 制法:移取浓盐酸90 mL,用蒸馏水稀释至1 000 mL,121℃高压灭菌15 min。 (8)革兰氏染液 ① 结晶紫染色液:结晶紫 1.0 g,95%乙醇 20 mL,1%草酸铵水溶液 80 mL

将结品紫溶于乙醇中,然后与草酸铵溶液混合。 ②革兰氏碘液:碘1.0g,碘化钾20g 荒水300m. 将碘和碘化钾先进行混合,加入蒸馏水少许,充分振荡,待完全溶解后,再加入蒸馆 水至300mL ③沙黄复染液:沙黄0.25g,95%乙醇10mL,燕馏水90mL。将沙黄溶于乙醇中, 然后再用蒸馏水稀释。 (一)大肠菌群MPN计数法(第一法) 大肠菌群MPN计数法的检验程序见图12-1。 1.操作步骤 (1)检样稀释 ①固体和半固体样品:称取25g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8000-10000rmin均质1min-2min.或放入盛有225mL稀释液的无南均质袋 中,用拍击式均质器拍打1mm ②液体样品: 以无菌 菌锥形瓶(瓶内预置适当数量的无南玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③样品匀液的pH应在6.5~7.5之间,必要时分别用1 mol/L NaOH或1 mol/L HC1调 节。 ④用1mL无南吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀 释液的无茵试管中( 注意吸管或吸头尖端不触及稀释液面) ,振摇试管或换用1支无菌吸 管反复吹打使其混合均匀,制成1:100的样品匀液 ⑤另取1mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增稀 释一次,换用1次1mL无菌吸管或吸头。 (2)初发酵试验:根据对检样污染状况的估计,洗择3个活官稀释度的样品匀液(液 体样品可以选择原液) 每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管 (如接种量超过1mL,则用双料LST肉汤),36C±1C培养2 h2h,观察倒管内是 否有气泡产生,24h2h产气者进行复发酵试验,如未产气则继续培养至48h+2h,产气者进 行复发酵试验。未产气者为大肠菌群阴性。 (3)复发酵试验:用接种环从产气的ST肉汤管中分别取培养物1环,移种于煌绿乳 糖胆盐肉汤(BGLB)管中,36℃±1℃培养482h,观察产气情况。产气者,计为大肠菌 群阳性管 (4)大肠菌群最可能数(MPN)的报告:按确证的大肠菌群LST阳性管数,检索MPN 表(表1-2-1),报告每g(mL)样品中大肠菌群的MPW值
将结晶紫溶于乙醇中,然后与草酸铵溶液混合。 ② 革兰氏碘液:碘 1.0 g,碘化钾 2.0 g,蒸馏水 300 mL。 将碘和碘化钾先进行混合,加入蒸馏水少许,充分振荡,待完全溶解后,再加入蒸馏 水至 300 mL。 ③ 沙黄复染液:沙黄 0.25 g,95%乙醇 10 mL,蒸馏水 90 mL。将沙黄溶于乙醇中, 然后再用蒸馏水稀释。 (一)大肠菌群MPN计数法(第一法) 大肠菌群MPN计数法的检验程序见图1-2-1。 1. 操作步骤 (1)检样稀释 ① 固体和半固体样品:称取25 g样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8 000~10 000 r/min均质1 min~2 min,或放入盛有225 mL稀释液的无菌均质袋 中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 ② 液体样品:以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液或生理盐水的无 菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③ 样品匀液的pH 应在6.5~7.5之间,必要时分别用1 mol/L NaOH 或1 mol/L HCl 调 节。 ④ 用1mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于盛有9 mL稀 释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸 管反复吹打使其混合均匀,制成1:100的样品匀液。 ⑤ 另取1mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增稀 释一次,换用1次1 mL 无菌吸管或吸头。 (2)初发酵试验:根据对检样污染状况的估计,选择3个适宜稀释度的样品匀液(液 体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接 种1 mL(如接种量超过1 mL,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内是 否有气泡产生,24h±2h产气者进行复发酵试验,如未产气则继续培养至48h±2h,产气者进 行复发酵试验。未产气者为大肠菌群阴性。 (3)复发酵试验:用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳 糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌 群阳性管。 (4)大肠菌群最可能数(MPN)的报告:按确证的大肠菌群LST阳性管数,检索MPN 表(表1-2-1),报告每g(mL)样品中大肠菌群的MPN值
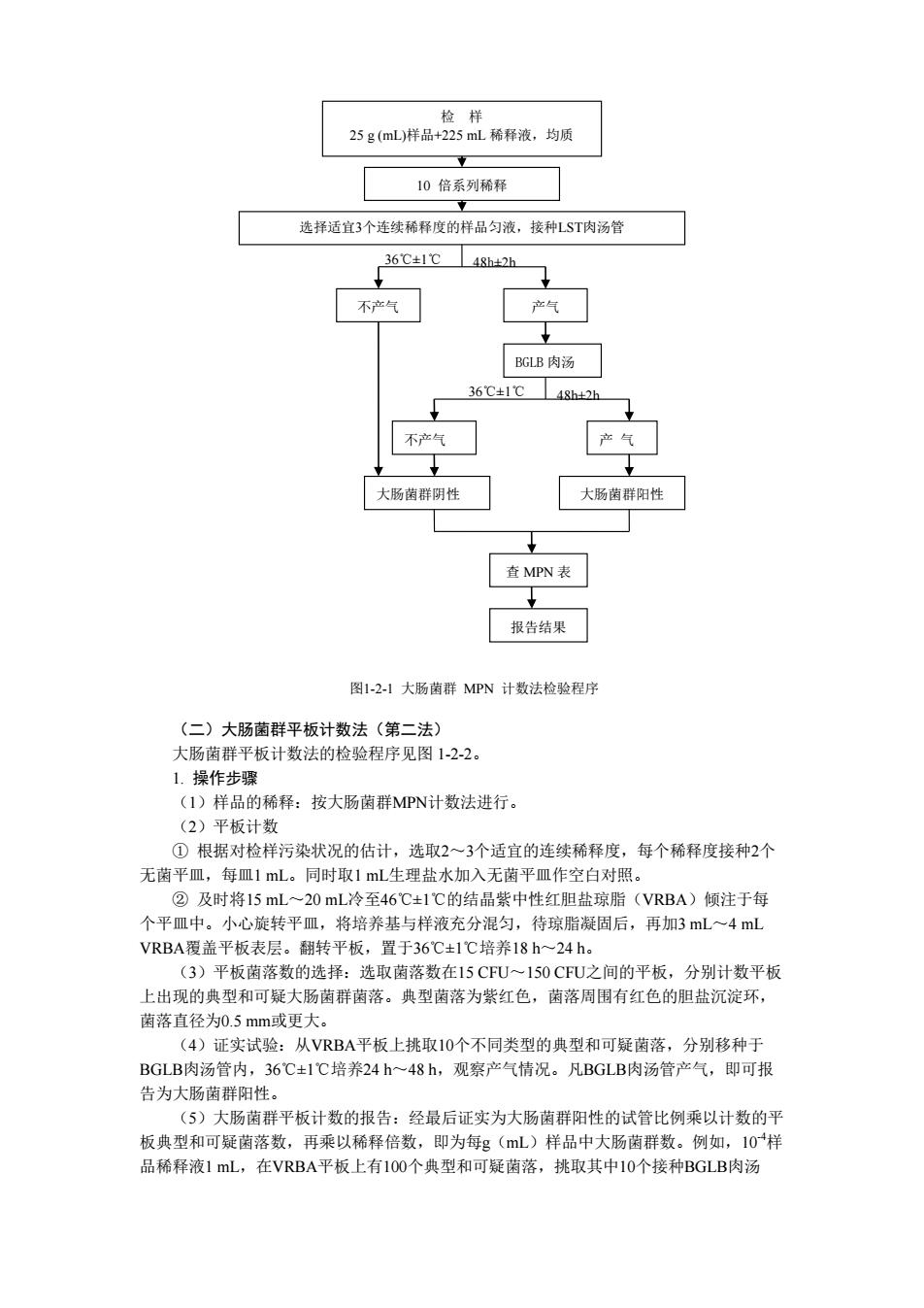
25g(mL样品+225mL稀释液,均质 10倍系列稀释 选择适宜3个连续稀释度的样品匀液,接种LST肉汤管 36C±1℃48d2h 不产气 产气 GLB肉汤 36℃±1℃4gh42 大肠菌群阴性 大肠菌群阳性 查MPN表 报告结果 图1-21大肠菌群MPN计数法检验程序 (二)大肠菌群平板计数法(第二法) 大肠菌群平板计数法的检验程序见图1-2-2。 L.操作步骤 (1)样品的稀释:按大肠菌群MPN计数法进行。 (2)平板计数 ①根据对检样污染状况的估计,选取2一3个适宜的连续稀释度,每个稀释度接种2个 无菌平皿,每皿1ml。同时取1L生理盐水加入无菌平皿作空白对照。 ②及时将15mL~20mL冷至46C±1℃的结晶紫中性红胆盐琼脂(VRBA)倾注于每 个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3mL一4mL VRBA覆盖平板表层。翻转平板,置于36C±1C培养18h~24h。 (3)平板菌落数的选择:选取菌落数在15C℉U~150C℉U之间的 ,分别计数平 上出现的典型可聚大肠菌商家·臭面客为紫红色,菌陈周同有红色的测盖沉淀不 菌落直径为0.5mm或更大。 (4)证实试验:从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于 BGLB肉汤管内,36℃±1℃培养24h~48h,观察产气情况。凡BGLB肉汤管产气,即可报 为大肠菌群阳性 (5)大肠菌群平板计数的报告:经最后证实为大肠菌群阳性的试管比例乘以计数的 板典型和可疑菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。例如,10样 品稀释液1mL,在VRBA平板上有1O0个典型和可疑菌落,挑取其中10个接种BGLB肉汤
(二)大肠菌群平板计数法(第二法) 大肠菌群平板计数法的检验程序见图 1-2-2。 1. 操作步骤 (1)样品的稀释:按大肠菌群MPN计数法进行。 (2)平板计数 ① 根据对检样污染状况的估计,选取2~3个适宜的连续稀释度,每个稀释度接种2个 无菌平皿,每皿1 mL。同时取1 mL生理盐水加入无菌平皿作空白对照。 ② 及时将15 mL~20 mL冷至46℃±1℃的结晶紫中性红胆盐琼脂(VRBA)倾注于每 个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3 mL~4 mL VRBA覆盖平板表层。翻转平板,置于36℃±1℃培养18 h~24 h。 (3)平板菌落数的选择:选取菌落数在15 CFU~150 CFU之间的平板,分别计数平板 上出现的典型和可疑大肠菌群菌落。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环, 菌落直径为0.5 mm或更大。 (4)证实试验:从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于 BGLB肉汤管内,36℃±1℃培养24 h~48 h,观察产气情况。凡BGLB肉汤管产气,即可报 告为大肠菌群阳性。 (5)大肠菌群平板计数的报告:经最后证实为大肠菌群阳性的试管比例乘以计数的平 板典型和可疑菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。例如,10-4样 品稀释液1 mL,在VRBA平板上有100个典型和可疑菌落,挑取其中10个接种BGLB肉汤 检 样 25 g (mL)样品+225 mL 稀释液,均质 10 倍系列稀释 选择适宜3个连续稀释度的样品匀液,接种LST肉汤管 36℃±1℃ 产气 BGLB 肉汤 不产气 产 气 48h±2h 不产气 大肠菌群阴性 大肠菌群阳性 查 MPN 表 报告结果 36℃±1℃ 48h±2h 图1-2-1 大肠菌群 MPN 计数法检验程序

管,证实有6个阳性管,则该样品的大肠菌群数为:100×6/10x10g(mL)=6.0×10CFUg (mL) 10倍系列稀释 选择2一3个适宜稀释度的样品匀液,接种VRBA平板 36℃1℃18h~24h 计数典型和可疑菌落 BGLB肉汤 36c+124h-48 报告结果 图12-2大肠菌群平板计数法检验程序 表1-21大肠菌群最可能数(MPN)检索表 阳性管 95%可信限 0.10 0.001 MPN 0.01 下限 上限 0 0 0 9.5 0 0 0 015 3 0 0 18 0 0 1 0 88 1 0 0 7.4 613 2 1 11 ( 562 2 66515455 2 2 2 405022 8222582222424 22 35 87
管,证实有6个阳性管,则该样品的大肠菌群数为:100×6/10×104 /g(mL)=6.0×105CFU/g (mL)。 、 表 1-2-1 大肠菌群最可能数(MPN)检索表 阳性管数 MPN 95%可信限 0.10 0.01 0.001 下限 上限 0 0 0 <3.0 — 9.5 0 0 1 3.0 0.15 9.6 0 1 0 3.0 0.15 11 0 1 1 6.1 1.2 18 0 2 0 6.2 1.2 18 0 3 0 9.4 3.6 38 1 0 0 3.6 0.17 18 1 0 1 7.2 1.3 18 1 0 2 11 3.6 38 1 1 0 7.4 1.3 20 1 1 1 11 3.6 38 1 2 0 11 3.6 42 1 2 1 15 4.5 42 1 3 0 16 4.5 42 2 0 0 9.2 1.4 38 2 0 1 14 3.6 42 2 0 2 20 4.5 42 2 1 0 15 3.7 42 2 1 1 20 4.5 42 2 1 2 27 8.7 94 2 2 0 21 4.5 42 2 2 1 28 8.7 94 2 2 2 35 8.7 94 检 样 25 g(mL)样品+225mL 稀释液,均质 10 倍系列稀释 选择 2~3个适宜稀释度的样品匀液,接种VRBA平板 36℃±1℃ 计数典型和可疑菌落 BGLB 肉汤 报告结果 18h~24h 36℃±1℃ 24h~48h 图 1-2-2 大肠菌群平板计数法检验程序

3 0 29 8.7 3 36 8 、2 0 46 3 3 64 17 3 0 9 120 3 3 160 0 9 18 420 150 37 420 210 40 430 290 1.00 3 0 240 42 1.0m 3 3 46n 3.000 3 1100 180 4,100 >1100 420 注:①本表采用3个稀释度0.1g(mL)、0.01g(mL)和0.001gmlL小,每个稀释度接种3管.②表内 所列检样量如政用g(mL)、0.1g(mL)和0.01g(mL)时。 表内数 应相应降低10倍:如改用001g(mL) 0.001g(ml、0.0001g(mL)时,则表内数字应相应增高10倍,其余类推。 三、动物性食品中沙门氏菌的检验 沙门氏菌属(Salmor ell@)是肠杆菌科的一个大属,也是肠杆菌科中最重要的病原菌属,沙 门氏菌屈(Salmonella)为肠杆菌科中的一个大属,仅包括2个种,即肠道沙门氏南(S.enterica) 和博恩格律沙门氏菌(S.bongori)。引起人和食品动物发生感染最常见的属于肠道亚种。沙 门氏菌约有2000多个血清型和变种,我国已发现120多个血清型。本属细菌绝大多数成员 对人和动物有致病性,能引起人和动物的败血症与目肠炎,其至流产,并能引起人类食物中 毒,是人类细菌性食物中毒的最主要病原茵之 世界各地的食物中毒病例中,英国、中国 沙门氏菌食物中毒居首位,美国沙门氏菌食物中毒居第二位。沙门氏菌常作为食品致病菌指 标。食品中沙门氏菌检验按GB4789.4一2010《食品安全国家标淮食品微生物学检验沙门 氏菌检验》进行。 1设备和材料除微生物实验室常规灭菌及培养设各外,其他设备和材料如下: (2)恒温培养箱:36C±1C,42℃±1℃ (3)均质器。 (4)振荡器。 (5)电子天平:感量01g (6)无菌锥形瓶:容量500mL,250mL (7)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及 吸头 (8)无菌培养皿:直径90mm。 (9)无菌试管:3mm×50mm、10mm×75mm。 (10)无南毛细管。 (II)pH计或pH比色管或精密pH试纸。 (12)全自动微生物生化鉴定系统
2 3 0 29 8.7 94 2 3 1 36 8.7 94 3 0 0 23 4.6 94 3 0 1 38 8.7 110 3 0 2 64 17 180 3 1 0 43 9 180 3 1 1 75 17 200 3 1 2 120 37 420 3 1 3 160 40 420 3 2 0 93 18 420 3 2 1 150 37 420 3 2 2 210 40 430 3 2 3 290 90 1,000 3 3 0 240 42 1,000 3 3 1 460 90 2,000 3 3 2 1100 180 4,100 3 3 3 >1100 420 -- 注:①本表采用3个稀释度[0.1g (mL)、0.01 g (mL)和 0.001 g (mL)],每个稀释度接种 3 管。②表内 所列检样量如改用lg(mL)、0.1 g (mL)和0.01g (mL)时,表内数字应相应降低10倍;如改用 0.01g (mL)、 0.001g (mL)、0.0001g (mL)时,则表内数字应相应增高10倍,其余类推。 三、动物性食品中沙门氏菌的检验 沙门氏菌属(Salmonella)是肠杆菌科的一个大属,也是肠杆菌科中最重要的病原菌属,沙 门氏菌属(Salmonella)为肠杆菌科中的一个大属,仅包括 2 个种,即肠道沙门氏菌(S.enterica) 和博恩格律沙门氏菌(S.bongori)。引起人和食品动物发生感染最常见的属于肠道亚种。沙 门氏菌约有 2 000 多个血清型和变种,我国已发现 120 多个血清型。本属细菌绝大多数成员 对人和动物有致病性,能引起人和动物的败血症与胃肠炎,甚至流产,并能引起人类食物中 毒,是人类细菌性食物中毒的最主要病原菌之一。世界各地的食物中毒病例中,英国、中国 沙门氏菌食物中毒居首位,美国沙门氏菌食物中毒居第二位。沙门氏菌常作为食品致病菌指 标。食品中沙门氏菌检验按 GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门 氏菌检验》进行。 1. 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: (1)冰箱:2℃~4℃。 (2)恒温培养箱:36℃±1℃,42℃±1℃。 (3)均质器。 (4)振荡器。 (5)电子天平:感量0.1 g。 (6)无菌锥形瓶:容量500 mL,250 mL。 (7)无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及 吸头。 (8)无菌培养皿:直径90 mm。 (9)无菌试管:3 mm×50 mm、10 mm×75 mm。 (10)无菌毛细管。 (11)pH计或pH比色管或精密pH 试纸。 (12)全自动微生物生化鉴定系统

2.培养基和试剂 (1)缓冲蛋白胨水(BPW) ①成分 蛋白胨10.0g,氯化钠50g,磷酸氢二钠(含12个结晶水)90g,磷酸二氢 钾1.5g,蒸馏水1000mL。 ②制法:将各成分加入蒸馏水中,搅混均匀,静置约10mi,煮沸溶解,调节pH 7.240.2,高压灭菌121℃,15min。 (2)四流猫静钠煌绿(TTB)增菌液 ①基础液: 蛋白胨10.0g,牛肉音5.0g,氯化钠3.0g,碳酸钙45.0g, 蒸馏水1000 mL。除碳酸钙外,将各成分加入蒸馏水中,煮沸溶解,再加入碳酸钙,调 pH7.0H02。,高压灭菌121℃,20min ②硫代硫酸钠溶液:硫代硫酸钠(含5个结品水)50.0g,蒸馏水加至100mL。高压 灭南121℃,20min。 ③曲溶液,曲片00。,化钾250。,蒸馏水加至100mL。将独化拥充分溶解干少 量的蒸馏水中,再投入碘片,振摇玻瓶至碘片全部溶解为止,然后加蒸馏水至规定的总 量,贮存于棕色瓶内,塞紧瓶盖备用。 ④0.5%煌绿水溶液:煌绿0.5g,蒸馏水100mL,溶解后,存放暗处,不少于1天,使 其自然灭菌。 ⑤牛胆盐溶液:牛胆盐10.0g,蒸馏水100mL,加热煮沸至完全溶解,高压灭菌 121c,20mim ⑥制法:基础液900mL,硫代硫酸钠溶液100mL,碘溶液20.0mL,煌绿水溶液2.0 mL,牛胆盐溶液50.0mL。临用前,按上列顺序,以无菌操作依次加入基础液中,每加入 一种成分,均应摇匀后再加入另一种成分。 (3)亚晒酸盐胱氨酸(SC)增茵液 ①成分:蛋白胨5.0g,乳糖4.0g,磷酸氢二钠10.0g,亚硒酸氢钠4.0gL胱氨酸 0.01g蒸馏水1000ml ②制法:除亚硒酸氢钠和L-胱氨酸外,将各成分加入蒸馏水中,煮沸溶解,冷至55℃ 以下,以无菌操作加入亚硒酸氢钠和1gLL-胱氨酸溶液10mL(称取0.1gL胱氨酸,加1 moM氢氧化钠溶液15mL,使溶解,再加无菌蒸馏水至1O0mL即成,如为DL-胱氨酸, 用量应加倍)。摇匀,调节p7.010.2。 (4)亚硫酸铋 (BS)琼脂 ①成分:蛋白胨10.0g,牛肉膏5.0g,葡萄糖5.0g,硫酸亚铁0.3g,磷酸氢二钠4.0 g,煌绿0.025g或5.0gL水溶液5.0mL,柠檬酸铋铵2.0g,亚硫酸纳6.0g,琼脂18.0g~20.0 g,蒸馏水1000mL。 ②制法:将前三种成分加入300mL.蒸馏水(制作基液),硫酸亚铁和磺酸氢二钠 分别加入20mL和30mL蒸馏水中,柠檬酸秘铵和亚硫酸钠分别加入另 20mL和30ml 蒸馏水中,琼脂加入600mL蒸馏水中。然后分别搅拌均匀,煮沸溶解 冷至80C左名 时,先将硫酸亚铁和磷酸氢二钠混匀,倒入基础液中,混匀。将柠檬酸秘铵和亚硫酸钠混 匀,倒入基础液中,再混匀。调节pH7.50.2,随即倾入琼脂液中,混合均匀,冷至50℃~ 55℃。加入煌绿溶液,充分混匀后立即倾注平皿。 注:①本培养基不需要高压灭菌,在制备过程中不宜过分加热,避免降低其达择性,贮于室温暗处 超过48h会降低其选择性。②本培养基宜于当天制备,第2天使用 (5)E琼脂 ①成分:蛋白胨12.0g,牛肉膏3.0g,乳糖12.0g,燕糖12.0g,水杨素2.0g,胆盐 20.0g,氯化钠5.0g,琼脂18.0g~20.0g,蒸馏水1000mL,0.4%溴麝香草酚蓝溶液16.0
2. 培养基和试剂 (1)缓冲蛋白胨水(BPW) ① 成分:蛋白胨10.0 g,氯化钠5.0 g,磷酸氢二钠(含12个结晶水)9.0 g,磷酸二氢 钾1.5 g,蒸馏水1 000 mL。 ② 制法:将各成分加入蒸馏水中,搅混均匀,静置约10 min,煮沸溶解,调节pH 7.2±0.2,高压灭菌121℃,15 min。 (2)四硫磺酸钠煌绿(TTB)增菌液 ① 基础液:蛋白胨10.0 g,牛肉膏5.0 g,氯化钠3.0 g,碳酸钙45.0 g,蒸馏水1 000 mL。除碳酸钙外,将各成分加入蒸馏水中,煮沸溶解,再加入碳酸钙,调节 pH7.0±0.2。,高压灭菌121℃,20 min。 ② 硫代硫酸钠溶液:硫代硫酸钠(含5个结晶水) 50.0 g,蒸馏水加至100 mL。高压 灭菌121℃,20 min。 ③ 碘溶液:碘片20.0 g,碘化钾25.0 g,蒸馏水加至100 mL。将碘化钾充分溶解于少 量的蒸馏水中,再投入碘片,振摇玻瓶至碘片全部溶解为止,然后加蒸馏水至规定的总 量,贮存于棕色瓶内,塞紧瓶盖备用。 ④ 0.5%煌绿水溶液:煌绿0.5 g,蒸馏水100 mL,溶解后,存放暗处,不少于1天,使 其自然灭菌。 ⑤ 牛胆盐溶液:牛胆盐10.0 g,蒸馏水100 mL,加热煮沸至完全溶解,高压灭菌 121℃,20 min。 ⑥ 制法:基础液900 mL,硫代硫酸钠溶液100 mL,碘溶液20.0 mL,煌绿水溶液2.0 mL,牛胆盐溶液50.0 mL。临用前,按上列顺序,以无菌操作依次加入基础液中,每加入 一种成分,均应摇匀后再加入另一种成分。 (3)亚硒酸盐胱氨酸(SC)增菌液 ① 成分:蛋白胨5.0 g,乳糖4.0 g,磷酸氢二钠10.0 g,亚硒酸氢钠4.0 g,L-胱氨酸 0.01 g,蒸馏水1 000 mL。 ② 制法:除亚硒酸氢钠和L-胱氨酸外,将各成分加入蒸馏水中,煮沸溶解,冷至55℃ 以下,以无菌操作加入亚硒酸氢钠和1 g/L L-胱氨酸溶液10 mL(称取0.1 g L-胱氨酸,加1 mol/L 氢氧化钠溶液15 mL,使溶解,再加无菌蒸馏水至100 mL 即成,如为DL-胱氨酸, 用量应加倍)。摇匀,调节pH 7.0±0.2。 (4)亚硫酸铋(BS)琼脂 ① 成分:蛋白胨10.0 g,牛肉膏5.0 g,葡萄糖5.0 g,硫酸亚铁0.3 g,磷酸氢二钠4.0 g,煌绿0.025 g或5.0 g/L水溶液5.0 mL,柠檬酸铋铵2.0 g,亚硫酸钠6.0 g,琼脂18.0 g~20.0 g,蒸馏水1 000 mL。 ② 制法:将前三种成分加入300 mL 蒸馏水(制作基础液),硫酸亚铁和磷酸氢二钠 分别加入20 mL和30 mL 蒸馏水中,柠檬酸铋铵和亚硫酸钠分别加入另一 20 mL和30 mL 蒸馏水中,琼脂加入600 mL 蒸馏水中。然后分别搅拌均匀,煮沸溶解。冷至80℃左右 时,先将硫酸亚铁和磷酸氢二钠混匀,倒入基础液中,混匀。将柠檬酸铋铵和亚硫酸钠混 匀,倒入基础液中,再混匀。调节pH 7.5±0.2,随即倾入琼脂液中,混合均匀,冷至50℃~ 55℃。加入煌绿溶液,充分混匀后立即倾注平皿。 注:①本培养基不需要高压灭菌,在制备过程中不宜过分加热,避免降低其选择性,贮于室温暗处, 超过48 h 会降低其选择性。②本培养基宜于当天制备,第2天使用。 (5)HE 琼脂 ① 成分:蛋白胨12.0 g,牛肉膏3.0 g,乳糖12.0 g,蔗糖12.0 g,水杨素2 .0 g,胆盐 20.0 g,氯化钠5.0 g,琼脂18.0 g~20.0 g,蒸馏水1 000 mL,0.4%溴麝香草酚蓝溶液16.0