
第二章沉淀溶解平衡 1
1 第二章 沉淀溶解平衡

本章内容 §2-1 溶度积与溶解度 §2-2 影响沉淀溶解平衡的因素 §2-3 溶度积规则及其应用 2
2 §2-1 溶度积与溶解度 §2-2 影响沉淀溶解平衡的因素 §2-3 溶度积规则及其应用

本章学习要求 1.掌握溶度积K,。与溶解度的关系 2.掌握难溶电解质的溶度积规则 3.了解影响沉淀溶解平衡的因素
3 1.掌握溶度积Ksp ө与溶解度S的关系 2.掌握难溶电解质的溶度积规则 3.了解影响沉淀溶解平衡的因素 本 章 学 习 要 求

物质按溶解度分类 ◆5>1g/100g(H20) 易溶物质 ◆s=0.1~1g/100g(H20) 可溶物质 ◆s=0.01~0.1g/100g(H20) 微溶物质 ◆s<0.01g/100g(H20) 难溶物质 4
4 ◆ s > 1 g/100 g (H2O) ◆ s = 0.1 ~ 1 g/100 g (H2O) ◆ s = 0.01 ~ 0.1 g/100 g (H2O) ◆ s 0.01 g/100 g (H2O) 物质按溶解度分类 易溶物质 可溶物质 微溶物质 难溶物质

·假设1:难溶电解质溶解的部分是完全电离的,溶液中不存在 未解离的; ·假设2:难溶电解质溶于纯水的部分全部以简单的水合离子存 在,不存在质子化和羟基化的形式。 ·水合离子:是指水溶液中的离子和一定数目水分子结合成的 离子。水溶液中的离子大都以水合离子形式存在。 ·质子化:获得一个氢离子,而带正电,使它具备更强的亲电性) ·羟基化:羟基化是指向有机化合物分子中引入羟基的反应 5
5 • 假设1:难溶电解质溶解的部分是完全电离的,溶液中不存在 未解离的; • 假设2:难溶电解质溶于纯水的部分全部以简单的水合离子存 在,不存在质子化和羟基化的形式。 • 水合离子:是指水溶液中的离子和一定数目水分子结合成的 离子。水溶液中的离子大都以水合离子形式存在。 • 质子化:获得一个氢离子,而带正电,使它具备更强的亲电性) • 羟基化:羟基化是指向有机化合物分子中引入羟基的反应

§2-1 溶度积与溶解度 ☐一、溶度积常数 二、溶度积与溶解度的关系 6
6 §2-1 溶度积与溶解度 一、溶度积常数 二、 溶度积与溶解度的关系

一、溶度积常数 溶解 AgCI(s) Ag (aq)+CF (aq) 沉淀 K=[c(Ag*)/c]c(CI-)/c]
7 AgCl(s) Ag+ (aq) + Cl- (aq) 溶解 沉淀 一、 溶度积常数 K [c(Ag )/c ][c(Cl )/c ] θ θ θ sp + − Ksp =

溶度积 沉淀溶解平衡常数K9(Kp) AmDn(s)±mAn时(aq+nD"(aq) 平衡时 Kc"(A)c"Dm-) 定温度下,难溶电解质饱和溶液中各 离子浓度(活度)以其计量系数为指数的乘 积为一常数 8
8 溶度积 K ( K ) sp sp 沉淀溶解平衡常数 Am Dn(s) mA n+ (aq) nD m- + (aq) 平衡时 (A ) c (D ) m n+ n m− K =c sp 一定温度下,难溶电解质饱和溶液中各 离子浓度(活度)以其计量系数为指数的乘 积为一常数
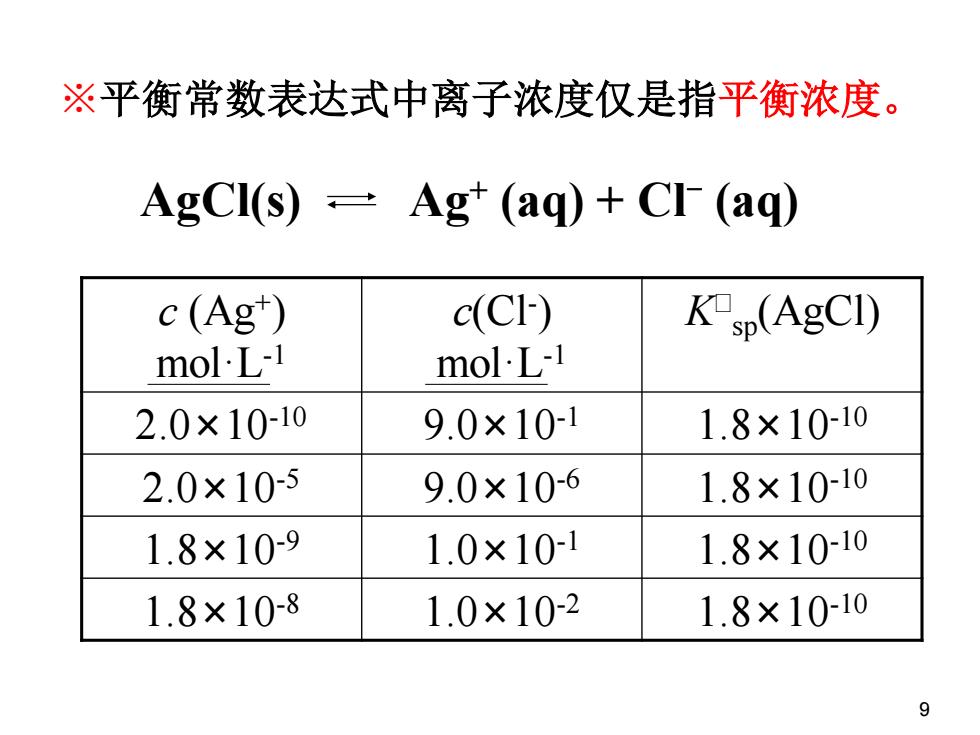
※平衡常数表达式中离子浓度仅是指平衡浓度。 AgCI(s)-Ag (aq)+Cl (aq) c(Ag") c(CF) Ksp(AgCI) molL-1 molL-1 2.0×10-10 9.0×101 1.8×10-10 2.0×10-5 9.0×10-6 1.8×10-10 1.8×10-9 1.0×10-1 1.8×10-10 1.8×10-8 1.0×10-2 1.8×10-10 9
9 ※平衡常数表达式中离子浓度仅是指平衡浓度。 c (Ag+ ) mol·L-1 c(Cl- ) mol·L-1 K sp(AgCl) 2.0×10-10 9.0×10-1 1.8×10-10 2.0×10-5 9.0×10-6 1.8×10-10 1.8×10-9 1.0×10-1 1.8×10-10 1.8×10-8 1.0×10-2 1.8×10-10 AgCl(s) Ag+ (aq) + Cl- (aq)

K、的性质: ①其值的大小与难溶电解质的本性和温度有关,而 与沉淀的量的多少及溶液中离子浓度的变化无关。 ②离子浓度的变化只能使平衡移动,并不改变溶度 积。 四的来源: ①根据定义,通过实验测定。 ②通过热力学函数计算:lnK四=一△GmRT。 10
10 K sp的性质: ①其值的大小与难溶电解质的本性和温度有关,而 与沉淀的量的多少及溶液中离子浓度的变化无关。 ②离子浓度的变化只能使平衡移动,并不改变溶度 积。 K sp的来源: ①根据定义,通过实验测定。 ②通过热力学函数计算: lnK =-∆rGm /RT