
前言 什么是计算化学(What?) ● 为什么学习计算化学?(Why?) 计算化学的过去、现在和未来 如何学习计算化学 (How?) 本课程教学安排 回
前言 • 什么是计算化学(What?) • 为什么学习计算化学?(Why?) • 计算化学的过去、现在和未来 • 如何学习计算化学 (How?) • 本课程教学安排

二十世纪八十年代以来,先进的分析 仪器的应用、量子化学计算方法的进展和 计算机技术的飞速发展,对化学科学的发 展产生了冲击性的影响。其研究内容、方 法、乃至学科的结构和性质都在发生深刻 的变化。 长期以来,化学一直被科学界公认为 门纯实验科学。其理由要追溯到人类认 识自然的两种科学方法
二十世纪八十年代以来,先进的分析 仪器的应用、量子化学计算方法的进展和 计算机技术的飞速发展,对化学科学的发 展产生了冲击性的影响。其研究内容、方 法、乃至学科的结构和性质都在发生深刻 的变化。 长期以来,化学一直被科学界公认为 一门纯实验科学。其理由要追溯到人类认 识自然的两种科学方法
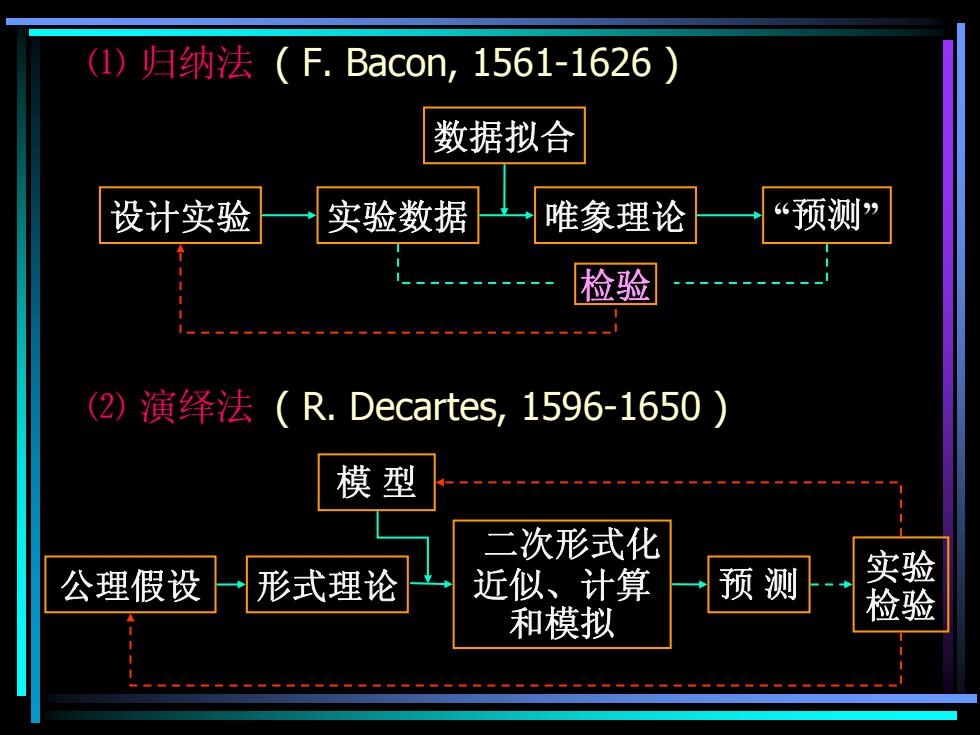
(1)归纳法(F.Bacon,1561-1626) 数据拟合 设计实验 实验数据 唯象理论 “预测” 检验 (2)演绎法(R.Decartes,1596-1650) 模型 二次形式化 公理假设 形式理论 近似、计算 预测 实验 和模拟 检验
⑴ 归纳法 ( F. Bacon, 1561-1626 ) ⑵ 演绎法 ( R. Decartes, 1596-1650 ) 设计实验 实验数据 唯象理论 “预测” 数据拟合 检验 公理假设 形式理论 二次形式化 近似、计算 和模拟 预 测 模 型 实验 检验

归纳法(Reduction)与演绎法(Deduction)的比较 依据 目标 数学工具 归纳法 经验公式、规律 实验事实 较简单 →唯象理论 正确普适的 较高级、 演绎法 形式理论 公理和假设 复杂 迄80年代,归纳法是多数化学家采用的唯一科 学方法;演绎法在化学界从未得到普遍承认。 原因:①对象复杂;②习惯观念
依 据 目 标 数学工具 归纳法 实验事实 经验公式、规律 ⇒ 唯象理论 较简单 演绎法 正确普适的 公理和假设 形式理论 较高级、 复杂 • 迄80年代,归纳法是多数化学家采用的唯一科 学方法;演绎法在化学界从未得到普遍承认。 • 原因:①对象复杂;②习惯观念 归纳法(Reduction)与演绎法(Deduction)的比较

运用数学的多 少是一门科学成熟 的程度的标志。 马克思
运用数学的多 少是一门科学成熟 的程度的标志。 运用数学的多 少是一门科学成熟 的程度的标志。 马克思

数学的应用:在刚体 力学中是绝对的,在气体 力学中是近似的,在液体 力学中就已经比较困难 了;在物理学中是试验性 的和相对的;在化学中是 最简单的一次方程式;在 生物学中等于零。 恩格斯
数学的应用:在刚体 力学中是绝对的,在气体 力学中是近似的,在液体 力学中就已经比较困难 了;在物理学中是试验性 的和相对的;在化学中是 最简单的一次方程式;在 生物学中等于零。 数学的应用:在刚体 力学中是绝对的,在气体 力学中是近似的,在液体 力学中就已经比较困难 了;在物理学中是试验性 的和相对的;在化学中是 最简单的一次方程式;在 生物学中等于零。 恩格斯

恩格斯的论断反映了19世纪中叶 自然科学各学科的“成熟程度”。 表明各学科研究对象一物质运动 形式与规律一其复杂程度的差异 然而,百年来科技的发展使各学 科的“成熟程度”发生了巨大变化
• 恩格斯的论断反映了19世纪中叶 自然科学各学科的“成熟程度”。 表明各学科研究对象⎯ 物质运动 形式与规律⎯ 其复杂程度的差异 • 然而,百年来科技的发展使各学 科的“成熟程度”发生了巨大变化
化学科学发展简要回顾 50

无机、有机化学在19世纪率先建立 治金、建材工业推动了无机 经阶壁羚、构宾有学基础 234 5 9101112131415161718 e Periodic Chart of Chemical Kr Xe Bi Po:At.Rn 镧系恒可阿丽阿阿四阿西西西回西西回 锕系丽西阿西阿阿丽何国阿丽阿阿
冶金、建材工业推动了无机 药物、染料、酿酒工业推动了有机 冶金、建材工业推动了无机 药物、染料、酿酒工业推动了有机 ⎯ 元素周期表奠定无机化学基础 无机、有机化学在19世纪率先建立 ⎯ 经典价键理论、苯结构奠定有机化学基础

@物理化学在20世纪初形成。旨在揭示化 学反应的普遍规律一 反应进行的方向、 程度和速度. Gibbs Gibbs自由能: 化学热力学 G=H-TS Arrhenius 反应速率常数: -Ea 化学动力学 k=Ae YRT
物理化学在20世纪初形成。旨在揭示化 学反应的普遍规律 — 反应进行的方向、 程度和速度… Gibbs − 化学热力学 Gibbs自由能: G = H − TS 反应速率常数: 反应速率常数: RT Ea k eA − = Arrhenius − 化学动力学