第五章蛋白质 a-carbon 石河子大学食品学院 主讲:赵多勇 LOGO
LOGO 石河子大学食品学院 主 讲:赵多勇

第三节蛋白质的结构 二、稳定蛋白质结构的作用力 1.空间相互作用 ①氨基酸残基侧链 ② φ和Ψ角的转动受到很大的限制 ③ 构象有限 ④ 避免自由能的增加 键长和键角的变形 www.themegallery.com LGO
www.themegallery.com LOGO 二、稳定蛋白质结构的作用力 1.空间相互作用 ① 氨基酸残基侧链 ② φ和ψ角的转动受到很大的限制 ③ 构象有限 ④ 避免自由能的增加 ⑤ 键长和键角的变形 第三节 蛋白质的结构

2.范德华力an der waals force) (1)广义上的范德华力包括3种较弱的作用力:定 向效应,诱导效应,分散效应。就个别来说范德华 力是很弱的,但其相互作用数量大且有加和效应和 位相效应,因此成为一种不可忽视的作用力。 (2)在整个蛋白质大分子中,极性基团之间、极性 与非极性基团之间、非极性基团之间都存在有这种 吸引力。 www.themegallery.com LOGO
www.themegallery.com LOGO 2.范德华力(van der waals force) (1)广义上的范德华力包括3种较弱的作用力:定 向效应,诱导效应,分散效应。就个别来说范德华 力是很弱的,但其相互作用数量大且有加和效应和 位相效应,因此成为一种不可忽视的作用力。 (2)在整个蛋白质大分子中,极性基团之间、极性 与非极性基团之间、非极性基团之间都存在有这种 吸引力
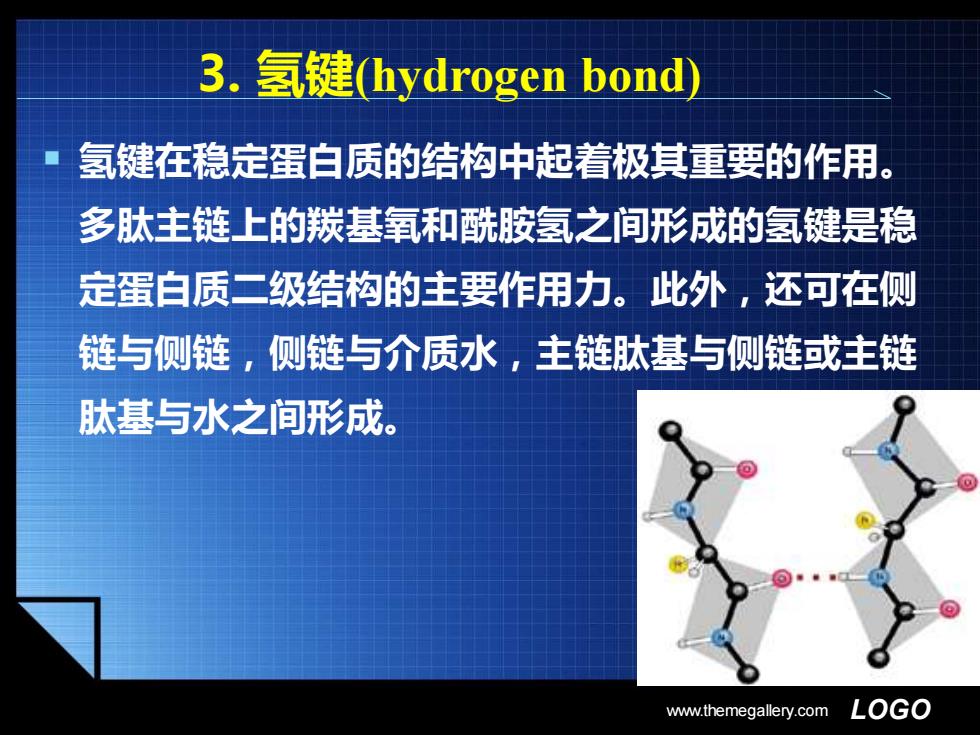
3.氢键hydrogen bond) 氢键在稳定蛋白质的结构中起着极其重要的作用。 多肽主链上的羰基氧和酰胺氢之间形成的氢键是稳 定蛋白质二级结构的主要作用力。此外,还可在侧 链与侧链,侧链与介质水,主链肽基与侧链或主链 肽基与水之间形成。 www.themegallery.com LGO
www.themegallery.com LOGO 3. 氢键(hydrogen bond) ▪ 氢键在稳定蛋白质的结构中起着极其重要的作用。 多肽主链上的羰基氧和酰胺氢之间形成的氢键是稳 定蛋白质二级结构的主要作用力。此外,还可在侧 链与侧链,侧链与介质水,主链肽基与侧链或主链 肽基与水之间形成

可在两肽链间,或一条肽链的不同部位形成氢键; 在o-螺旋和邮折叠片结构中肽键的N-H和C=O之 间形成的氢键数目最大;氢键对于维持蛋白质二级 结构、保持蛋白质稳定性起着重要的作用。 www.themegallery.com LOGO
www.themegallery.com LOGO ▪ 可在两肽链间,或一条肽链的不同部位形成氢键; 在-螺旋和β-折叠片结构中肽键的N-H和C=O之 间形成的氢键数目最大;氢键对于维持蛋白质二级 结构、保持蛋白质稳定性起着重要的作用
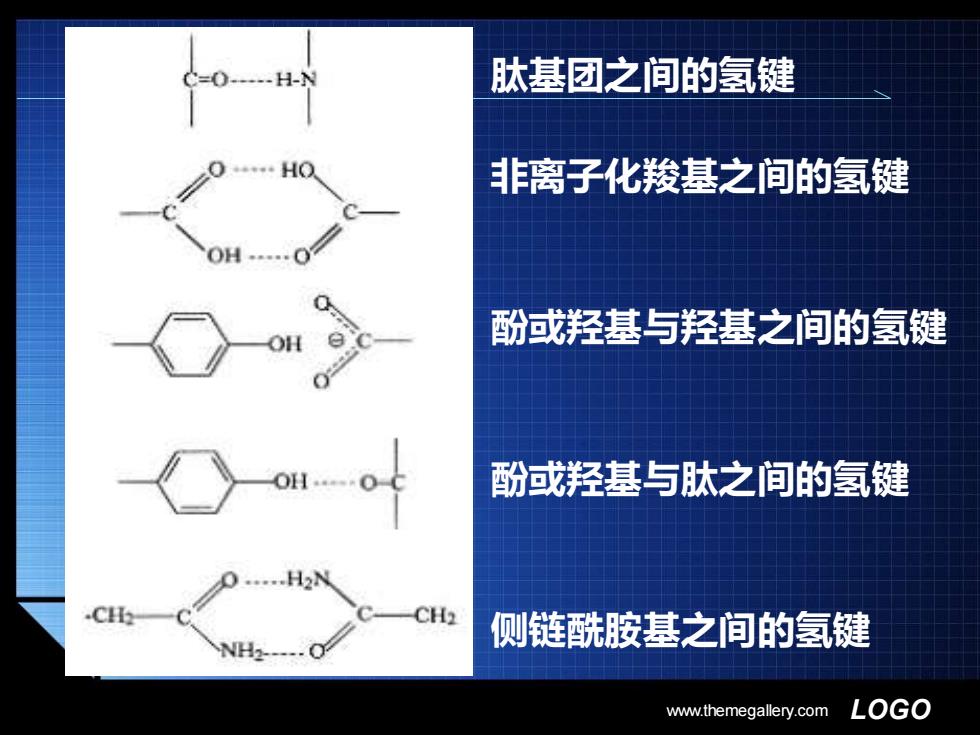
肽基团之间的氢键 非离子化羧基之间的氢键 酚或羟基与羟基之间的氢键 酚或羟基与肽之间的氢键 .H2N .CH 侧链酰胺基之间的氢键 ww.themegallery.com LOGO
www.themegallery.com LOGO ▪ 肽基团之间的氢键 ▪ 非离子化羧基之间的氢键 ▪ 酚或羟基与羟基之间的氢键 ▪ 酚或羟基与肽之间的氢键 ▪ 侧链酰胺基之间的氢键

4静电相互作用 蛋白质是多聚电解质,氨基酸带大量正负电荷,使 蛋白质形成静电相互作用,加入酸碱盐都会破坏它。 蛋白质含有一些带有可离解基团的氨基酸残基 >Asp、Glu残基带负电荷(中性pH) >Lys、Arg和His带正电荷(中性pH) >Cys、Tyr残基带负电荷(碱性pH) www.themegallery.com LOGO
www.themegallery.com LOGO 4.静电相互作用 蛋白质是多聚电解质,氨基酸带大量正负电荷,使 蛋白质形成静电相互作用,加入酸碱盐都会破坏它。 蛋白质含有一些带有可离解基团的氨基酸残基 ➢ Asp、Glu残基带负电荷(中性pH) ➢ Lys、Arg和His带正电荷(中性pH) ➢ Cys、Tyr残基带负电荷(碱性pH)

① 在中性H,净电荷取决于分子中正、负电荷残基的相 对数目。 ② 蛋白质分子净电荷为0时的H为等电点(pI)。 3 等离子点是指不存在电解质时蛋白质溶液的H。 www.themegallery.com LOGO
www.themegallery.com LOGO ① 在中性pH,净电荷取决于分子中正、负电荷残基的相 对数目。 ② 蛋白质分子净电荷为0时的pH为等电点(pI)。 ③ 等离子点是指不存在电解质时蛋白质溶液的pH

5.疏水相互作用(hydrophobic interaction) (1)介质中球状蛋白质的折叠总是倾向与把疏水残 基埋藏在分子的内部,这一现象称为疏水作用,它 在稳定蛋白质的三维结构方面占有突出地位。不是 疏水基团相互吸引,主要是介质水分子对疏水基团 的排斥所致,或者说是疏水基团为了避开水分子而 被迫靠近。 (2)驱动蛋白质折叠的主要力量,是维持蛋白质高 级结构的重要因素。 www.themegallery.com LOGO
www.themegallery.com LOGO 5.疏水相互作用(hydrophobic interaction) (1)介质中球状蛋白质的折叠总是倾向与把疏水残 基埋藏在分子的内部,这一现象称为疏水作用,它 在稳定蛋白质的三维结构方面占有突出地位。不是 疏水基团相互吸引,主要是介质水分子对疏水基团 的排斥所致,或者说是疏水基团为了避开水分子而 被迫靠近。 (2)驱动蛋白质折叠的主要力量,是维持蛋白质高 级结构的重要因素

6.二硫键 (1)绝大多数情况下二硫键是在多肽链的β·转角附 近形成的。二硫键的形成并不规定多肽链的折叠 然而一旦蛋白质采取了它的三维结构则二硫键的形 成将对此构象起稳定作用。假如蛋白质中所有的二 硫键相继被还原将引起蛋白质的天然构象改变和生 物活性丢失。在许多情况下二疏键可选择性的被还 原。 (2)球状蛋白分子中两个半胱氨酸分子之间-SH氧化 而成-S-S- www.themegallery.com LGO
www.themegallery.com LOGO 6.二硫键 (1)绝大多数情况下二硫键是在多肽链的β-转角附 近形成的。二硫键的形成并不规定多肽链的折叠, 然而一旦蛋白质采取了它的三维结构则二硫键的形 成将对此构象起稳定作用。假如蛋白质中所有的二 硫键相继被还原将引起蛋白质的天然构象改变和生 物活性丢失。在许多情况下二硫键可选择性的被还 原。 (2)球状蛋白分子中两个半胱氨酸分子之间-SH氧化 而成-S-S-