
A 作业习题汇总 1.回答下列问题, (1)画出O2作立方密堆时,一个晶胞中的八面体空隙和四面体空隙所在位置 (2)一个晶胞中有多少氧原子?多少个八面体和四面体空隙? (3)请确定在下列情况下需要填入阳离子的价态以及氧离子的配位数, ()所有的四面体空隙被境满: (b)所有的八面体空隙被填满: (c)一半的四面体空隙被填满 (d)一半的八面体空隙被填满。 【答案】(1)八面体空隙和四面体空隙如下图所示 图A1八而体空隙和四面体空隙 (2)一个晶胞中有4个氧原子,4个八面体空隙和8个四面体空隙. (3)假设M为阳离子: (a)四面体空隙数为氧原子数的两倍,所以化学式可写为M2O.M的静电键强度 为1/4,氧原子的配位数为2/(1/4)=8; 113
A 作业习题汇总 1.回答下列问题. (1)画出 O2− 作立方密堆时,一个晶胞中的八面体空隙和四面体空隙所在位置. (2)一个晶胞中有多少氧原子?多少个八面体和四面体空隙? (3)请确定在下列情况下需要填入阳离子的价态以及氧离子的配位数. (a)所有的四面体空隙被填满; (b)所有的八面体空隙被填满; (c)一半的四面体空隙被填满; (d)一半的八面体空隙被填满. 【答案】(1)八面体空隙和四面体空隙如下图所示. 图 A.1 八面体空隙和四面体空隙 (2)一个晶胞中有 4 个氧原子,4 个八面体空隙和 8 个四面体空隙. (3)假设 M 为阳离子: (a)四面体空隙数为氧原子数的两倍,所以化学式可写为 M2O.M 的静电键强度 为 1/4,氧原子的配位数为 2/(1/4)=8; 113

-114 A作业习题汇总 (b)八面体空隙数与氧原子数相等,所以化学式可写为MO.M的静电键强度为 2/6=1/3,氧原子的配位数为2/(1/3)=6: (c)一半的四面体空隙被填满,化学式可写为M0,1M的静电键强度为2/4=1/2, 氧原子的配位数为2/1/2)=4: ()一半的八面体空隙被填满,化学式可写为MO2,M的静电键强度为4/6-2/3, 氧原子的配位数为2/(2/3)=3。 【注】(1)空隙位置如果用坐标表示只需要写一个最简单的即可,如(001/2)可以 表示(001/2)、(01/20)、(1/200),且在坐标中0和1是一样的;此外不要忘记(1/2 1/21/2)也是一个八面体空隙. (3)先得到价态,后根据静电键强度计算出配位数而不是由配位数的到价态,逻辑 需要注意一下 2.已知下面的NaCl结构的晶体的点阵常数:Mg0一4.21A;MnO一4.44A;CaO -4.80A;Mgs-5.19A;MnS-5.21A;CaS-5.68A,请计算NaC1结构中Ca2+和02- 的Goldschmidt半径. 【答案】首先,按照阴离子密堆,阳离子填隙的规律,根据MgS和MS的点阵常 数几乎相等,推测结构未被撑开,因此得到$2-的半径为 )=x×519+521=184 再根据CaS的点阵常数,推测结构被撑开,因此可以得到Ca2+的半径为 RCa2+)=2×5.68-1.84=1.00A 由于S2-的半径比O2-的半径大,因此CO的结构也被撑开,因此可以得到O2-的 半径为 R02-)=7×4.80-1.00=1.40A 3.BTO3具有钙钛矿结构,室温下是一种铁电材料,具有四方结构.与高温立方 相的钙钛矿结构比,室温下BTO3的阴阳离子产生一定位移(如下图所示,为一个晶 胞沿a轴或者b轴的投影),从而产生自发极化.请计算BaTiO3自发极化强度的大小, 已知晶胞参数c=4.036A,a=b=3.992A. 【提示】根据大学物理的知识,极化强度的大小定义为单位体积内偶极矩的和,即 自发极化强度=单胞偶极矩/单胞体积. 【答案】单胞的偶极矩为 u=∑ql =8×发x0061+4e×012+2×-2×(←0.036 2 =0.674eA =1.078×10-29Cm
− 114 − A 作业习题汇总 (b)八面体空隙数与氧原子数相等,所以化学式可写为 MO.M 的静电键强度为 2/6=1/3,氧原子的配位数为 2/(1/3)=6; (c)一半的四面体空隙被填满,化学式可写为 MO,M 的静电键强度为 2/4=1/2, 氧原子的配位数为 2/(1/2)=4; (d)一半的八面体空隙被填满,化学式可写为 MO2,M 的静电键强度为 4/6=2/3, 氧原子的配位数为 2/(2/3)=3. 【注】(1)空隙位置如果用坐标表示只需要写一个最简单的即可,如 (0 0 1/2) 可以 表示 (0 0 1/2)、(0 1/2 0)、(1/2 0 0),且在坐标中 0 和 1 是一样的;此外不要忘记 (1/2 1/2 1/2) 也是一个八面体空隙. (3)先得到价态,后根据静电键强度计算出配位数而不是由配位数的到价态,逻辑 需要注意一下. 2. 已知下面的 NaCl 结构的晶体的点阵常数:MgO—4.21Å;MnO—4.44Å;CaO —4.80Å;MgS—5.19 Å;MnS—5.21Å;CaS—5.68Å, 请计算 NaCl 结构中 Ca2+ 和 O2− 的 Goldschmidt 半径. 【答案】首先,按照阴离子密堆,阳离子填隙的规律,根据 MgS 和 MnS 的点阵常 数几乎相等,推测结构未被撑开,因此得到 S2− 的半径为 R(ak−) = √2 4 × 5.19 + 5.21 2 = 1.84³. 再根据 CaS 的点阵常数,推测结构被撑开,因此可以得到 Ca2+ 的半径为 R(* k+) = 1 2 × 5.68 − 1.84 = 1.00³. 由于 S2− 的半径比 O2− 的半径大,因此 CaO 的结构也被撑开,因此可以得到 O2− 的 半径为 R(Pk−) = 1 2 × 4.80 − 1.00 = 1.40³. 3. BaTiO3 具有钙钛矿结构,室温下是一种铁电材料,具有四方结构.与高温立方 相的钙钛矿结构比,室温下 BaTiO3 的阴阳离子产生一定位移(如下图所示,为一个晶 胞沿 a 轴或者 b 轴的投影),从而产生自发极化.请计算 BaTiO3 自发极化强度的大小, 已知晶胞参数 c = 4.036Å,a = b = 3.992Å. 【提示】根据大学物理的知识,极化强度的大小定义为单位体积内偶极矩的和,即 自发极化强度 = 单胞偶极矩/单胞体积. 【答案】单胞的偶极矩为 µ = !ql = 8 × 2e 8 × 0.061 + 4e × 0.12 + 2 × −2e 2 × (−0.036) = 0.674e³ = 1.078 × 10−29*K

-115- 0061A↓ 图A.2第3题图 单胞的体积为 V=a2c=3.9922×4.036=64.32A3=6.432×1029m3 因此自发极化强度为 P,=台=0.1676C/m2 【注】偶极矩是正、负电荷中心间的距离和电荷中心所带电量的乘积,在本题中,如 果所有原子都在其平衡位置,整个晶体的偶极矩为0,是由于原子发生了偏移,整个晶 体具有了不为0的偶极矩,因此根据每个原子的电荷数和偏移量即可计算出偶极矩.需 要注意的是,需要考虑原子在晶胞中的贡献,同时需要规定一个偏移的正方向,此外对 于带负电的0原子还需要额外再加一个负号. 4.用硬球密堆来描述岩盐、闪锌矿和反萤石结构的结构特征,它们的结构的异同 点是什么?对于纤锌矿结构和NiAs结构,它们的异同点又是什么? 【答案】(1)同:阴离子fcc密堆或近似立方密堆,其他离子填隙 异:NaC1的八面体空隙全被占据,四面体空隙全空;闪锌矿的一半的四面体空隙 被占据,八面体空隙全空;反萤石的所有的四面体空隙被占据,八面体空隙全空 (2)同:都是阴离子hcp密堆. 异:阳离子的位置不同.纤锌矿结构占据一半的四面体间隙,其余一半四面体间隙 和全部八面体间隙空;NAs结构占据全部八面体空隙,而四面体间隙全空, 5.在讨论Bravais格子时,这些格子可看作由原始格子以及原始格子加面心或体 心组合而成,但一些由上述方法简单组合而成的格子不存在。主要原因是一些格子不符 合对称性要求或者可简化为另外一种格子.回答下面三个问题: (1)为什么没有立方底心格子? (2)为什么没有四方面心格子? (3)为什么没有四方底心格子? 【答案】(1)立方晶系具有三次轴(沿着格子或晶胞的体对角线),而立方底心格子 不具有三次轴,因此不符合对称性要求,故不存在
− 115 − O2- Ti4+ Ba2+ 0.061Å 0.036Å 0.12Å a c 图 A.2 第 3 题图 单胞的体积为 V = a2 c = 3.9922 × 4.036 = 64.32³3 = 6.432 × 10−29K3 . 因此自发极化强度为 Ps = µ V = 0.1676*/K 2 . 【注】偶极矩是正、负电荷中心间的距离和电荷中心所带电量的乘积,在本题中,如 果所有原子都在其平衡位置,整个晶体的偶极矩为 0,是由于原子发生了偏移,整个晶 体具有了不为 0 的偶极矩,因此根据每个原子的电荷数和偏移量即可计算出偶极矩.需 要注意的是,需要考虑原子在晶胞中的贡献,同时需要规定一个偏移的正方向,此外对 于带负电的 O 原子还需要额外再加一个负号. 4. 用硬球密堆来描述岩盐、闪锌矿和反萤石结构的结构特征,它们的结构的异同 点是什么?对于纤锌矿结构和 NiAs 结构,它们的异同点又是什么? 【答案】(1)同:阴离子 fcc 密堆或近似立方密堆,其他离子填隙. 异:NaCl 的八面体空隙全被占据,四面体空隙全空;闪锌矿的一半的四面体空隙 被占据,八面体空隙全空;反萤石的所有的四面体空隙被占据,八面体空隙全空. (2)同:都是阴离子 hcp 密堆. 异:阳离子的位置不同.纤锌矿结构占据一半的四面体间隙,其余一半四面体间隙 和全部八面体间隙空;NiAs 结构占据全部八面体空隙,而四面体间隙全空. 5. 在讨论 Bravais 格子时,这些格子可看作由原始格子以及原始格子加面心或体 心组合而成,但一些由上述方法简单组合而成的格子不存在.主要原因是一些格子不符 合对称性要求或者可简化为另外一种格子.回答下面三个问题: (1)为什么没有立方底心格子? (2)为什么没有四方面心格子? (3)为什么没有四方底心格子? 【答案】(1)立方晶系具有三次轴(沿着格子或晶胞的体对角线),而立方底心格子 不具有三次轴,因此不符合对称性要求,故不存在.

-116 A作业习题汇总 (②)对于四方面心格子,可以画出一个体积为面心格子一半的四方体心格子 (3)对于四方底心格子,可以画出一个体积为底心格子一半的四方原始格子 2- 图A.3四方底心格子是四方原始格子 【注】立方底心格子不存在的最本质原因是对称性不符合,而非最简;而四方底心 格子中有四次轴,因此是符合对称性要求的,但是可以化成更简单的格子所以不存在。 6.临界半径比的定义是:紧密堆积的阴离子恰好互相接触,并与中心的阳离子也 恰好接触的条件下,阳离子半径与阴离子半径之比.即每种配位体的阳、阴离子半径比 的下限.计算下列配位的临界半径比: (1)立方体配位; (2)八面体配位: (3)四面体配位: (4)三角形配位, 【答案】(1)立方体配位.在立方体的对角线上正负离子互相接触,在立方体的棱 上两个负离子相互接触,则 2(r++r-)=V5×2r-, 因此r+/r-=V3-1=0.732. (2)八面体配位.八面体中心对称的一对阴离子中心连线上正负离子相互接触,棱 上两个负离子相互接触,则 V2×2r-=2(r++r-), 因此r+/r-=√2-1=0.414. (3)四面体配位.四面体中的正离子直接与四个负离子相接触,四个负离子相互接 触,中心角为109.5°,因此底面上对角中心线长为2r-/W3,则 V(r++r-2-(2r-/W32=V(2r-)2-(2r-/W32-(r++r-), 因此r+/r-=0.225. (4)三角形配位.在同一平面内中心正离子与三个负离子直接接触,三个负离子相 互接触,则 ②P=2+[+)+V,+rP-月
− 116 − A 作业习题汇总 (2) 对于四方面心格子,可以画出一个体积为面心格子一半的四方体心格子. (3) 对于四方底心格子,可以画出一个体积为底心格子一半的四方原始格子. 图 A.3 四方底心格子是四方原始格子 【注】立方底心格子不存在的最本质原因是对称性不符合,而非最简;而四方底心 格子中有四次轴,因此是符合对称性要求的,但是可以化成更简单的格子所以不存在. 6. 临界半径比的定义是:紧密堆积的阴离子恰好互相接触,并与中心的阳离子也 恰好接触的条件下,阳离子半径与阴离子半径之比.即每种配位体的阳、阴离子半径比 的下限.计算下列配位的临界半径比: (1)立方体配位; (2)八面体配位; (3)四面体配位; (4)三角形配位. 【答案】(1)立方体配位.在立方体的对角线上正负离子互相接触,在立方体的棱 上两个负离子相互接触,则 2(r+ + r−) = √ 3 × 2r−, 因此 r+/r− = √3 − 1=0.732. (2)八面体配位.八面体中心对称的一对阴离子中心连线上正负离子相互接触,棱 上两个负离子相互接触,则 √ 2 × 2r− = 2(r+ + r−), 因此 r+/r− = √2 − 1=0.414. (3)四面体配位.四面体中的正离子直接与四个负离子相接触,四个负离子相互接 触,中心角为 109.5◦,因此底面上对角中心线长为 2r−/ √3,则 " (r+ + r−)2 − (2r−/ √ 3)2 = " (2r−)2 − (2r−/ √ 3)2 − (r+ + r−), 因此 r+/r− = 0.225. (4)三角形配位.在同一平面内中心正离子与三个负离子直接接触,三个负离子相 互接触,则 (2r−) 2 = r2 − + # (r+ + r−) + " (r+ + r−)2 − r2 − $2

-117- 因此4-=3-1=0155 2/3 【注】临界半径比通常是一个介于0到1之间的数字,因此如果计算出大于1的数 检查一下是否比反了 7.对于M2O5氧化物,写出下面缺陷的表达式:金属空位、金属间隙、氧空位、氧 间隙、氧空位、M取代一价的ML,M取代六价的Mh,电子和空穴缺陷. 【答案】w"、M、O、V6、Ma,M.e、, 8.请描述写缺陷方程式的三个原则,并详细描述下面的缺陷方程是否符合这些原 则,怎样符合或者不符合这些原则? (1)Mh2O3+3M=2Mh+3M+3O: (2)MX(M为1价)形成富金属化合物的缺陷方程写成M贷=M+e 【答案】缺陷方程的三个原则:物质守恒原则、电中性原则、格位比例不变原则; (1)符合原则 (2)不符合格位比例不变原则. 9.以M2O为例,写出氧气氛下形成缺氧、富金属、缺金属以及富氧的非化学计 量氧化物的缺陷方程,并写出相应的化学式. 【答案】缺氧氧化物M,0,-:08=6+2+号02gas): 富金属氧化物M+,0s:2M货+506=2M+02(gs)+10C; 缺金属氧化物:号02(gas)=2V"+50ǒ+10h: 富氧氧化物:02(gas)=0+2h. 1O.写出在氯气或钠气氛下,NaCl形成Na或C空位的缺陷方程 【答案】C气氛下形成Na空位:Cl(gas)=V%a+C8+h: C2气氛下形成C1空位:Cl各=Va+C2(gas)+e Na气氛下形成Na空位:Na。=a+Na(gas)+h'; Na气氛下形成Ci空位:Na(gas)-Va+Naa+d, 11.请分别写出在氧气氛下Mh2O和M20掺杂1MOg+z氧化物的缺陷方程。 【答案】高价掺杂:Mh205=2Mh5+20+30或Mhz05+4h:-2Mh+30+ Oz(gas) 低价掺杂:M20+02(gas)=2M1%+30ǒ+4h或M20+20=2M%+30ǒ 12.在存在多种阳离子的复合氧化物中,掺杂的阳离子进入哪个格位不是直接明了 的,需要根据一些因素进行判断,比如价态,离子半径等.请写出La(阳离子为正三 价,进人Ba的格位)摻杂具有钙钛矿结构的BTO3的缺陷方程,掺杂产生的点缺陷 通过电子缺陷补偿 【答案】La,0+2Ti02=2L+2T路+606+2+号02(gs. 13.请写出Sc203掺杂CaTiO3的缺陷方程,Sc原子进入Ti的格位,掺杂缺陷通 过氧空位进行电荷补偿
− 117 − 因此 r+/r− = ( √3 − 1)2 2 √3 = 0.155. 【注】临界半径比通常是一个介于 0 到 1 之间的数字,因此如果计算出大于 1 的数 检查一下是否比反了. 7. 对于 M2O5 氧化物,写出下面缺陷的表达式:金属空位、金属间隙、氧空位、氧 间隙、氧空位、M 取代一价的 Ml,M 取代六价的 Mh,电子和空穴缺陷. 【答案】V ##### J 、M••••• i 、O## i 、V •• P、M•••• JH、M# J?、e# 、h• . 8. 请描述写缺陷方程式的三个原则,并详细描述下面的缺陷方程是否符合这些原 则,怎样符合或者不符合这些原则? (1)Mh2O3 + 3M••• i = 2Mh••• i + 3M× J + 3O× P; (2)MX(M 为 1 价)形成富金属化合物的缺陷方程写成 M× J = J• i + e# . 【答案】缺陷方程的三个原则:物质守恒原则、电中性原则、格位比例不变原则; (1)符合原则; (2)不符合格位比例不变原则. 9. 以 M2O5 为例,写出氧气氛下形成缺氧、富金属、缺金属以及富氧的非化学计 量氧化物的缺陷方程,并写出相应的化学式. 【答案】缺氧氧化物 JkP5−x:P× P = V •• P + 2e# + 1 2 P2(; b); 富金属氧化物 J2+xO5:2J× J + 5P× P = 2J••••• i + 5 2 P2(; b) + 10e# ; 缺金属氧化物:5 2 P2(; b)=2V ##### J + 5P× P + 10h• ; 富氧氧化物:1 2 P2(; b) = P## i + 2h• . 10. 写出在氯气或钠气氛下,NaCl 形成 Na 或 Cl 空位的缺陷方程. 【答案】Cl2 气氛下形成 Na 空位:1 2 *H2(; b) = o# * + *H× *H + ?• ; Cl2 气氛下形成 Cl 空位:*H× *H = V • *H + 1 2 *H2(; b) + e# ; Na 气氛下形成 Na 空位:L × L = V # L + L (; b) + h• ; Na 气氛下形成 Cl 空位:L (; b) = V • *H + L × L + e# . 11. 请分别写出在氧气氛下 Mh2O5 和 Ml2O 掺杂 M2O3+x 氧化物的缺陷方程. 【答案】高价掺杂:J?2P5 = 2J?•• J + 2P## i + 3P× P 或 J?2P5 + 4h• = 2J?•• J + 3P× P + P2(; b); 低价掺杂:JH2P + P2(; b)=2JH## J + 3P× P + 4h• 或 JH2P + 2P## i = 2JH## J + 3P× P. 12.在存在多种阳离子的复合氧化物中,掺杂的阳离子进入哪个格位不是直接明了 的,需要根据一些因素进行判断,比如价态,离子半径等.请写出 La(阳离子为正三 价,进入 Ba 的格位)掺杂具有钙钛矿结构的 BaTiO3 的缺陷方程,掺杂产生的点缺陷 通过电子缺陷补偿. 【答案】G 2P3 + 2hBP2 = 2G • " + 2hB× hB + 6P× P + 2e# + 1 2 P2(; b). 13. 请写出 Sc2O3 掺杂 CaTiO3 的缺陷方程,Sc 原子进入 Ti 的格位,掺杂缺陷通 过氧空位进行电荷补偿.

-118 A作业习题汇总 【答案】2Ca0+Sc203=2Ca8.+50+2Sc+V6 14.请写出LaMnO,中产生的类似于Schottky缺陷的点缺陷方程,其中阳离子空 位只出现在La的格位, 【答案】2La+30×=2y"+3Vg+La203(solid). 15.(1)写出M0掺杂M2O3的缺陷方程,其中掺杂缺陷通过氧空位电荷平衡。 (2)写出在存在水蒸气的情况下,晶体中的氧空位被消除的缺陷方程. (3)写出在存在水蒸气的情况下,MO掺杂M2O3的缺陷方程,其掺杂缺陷通过掺 杂氢的缺陷电荷平衡。同时观察三个缺陷方程间的关系。 【答案】(1)2M0=2M+6+20谷: (2)H20(gas)+V6+Oǒ=20Ho; (3)2M10+H20(gas)=2Mk+20H6+0ǒ: 可见,(1)+(2)=(3). l6.写出CaF2掺杂CaO的缺陷方程,其中F取代O,CaO中的主要的缺陷为 Schottky缺陷 【答案】CaF2=2F。+Ca+V或CaF2+V6=2o+Can l7.推导M2O5晶体形成Schottky和Frenkel缺陷时缺陷浓度与温度的关系 【答案】(1)Schottky缺陷 缺陷方程:0=2Vw"+5V6 平衡常数:Ks=W?[g5 电中性条件:5=2V6 典精与度的关系:时-(停)”=k(器)》 (2)Frenkel缺陷 缺陷方程:M六=VW+M 平衡常数:KE=们M] 电中性条件:[V門=M 缺陷与温度的关系:]=-]=(K)P=K9ep(_△照 2RT 18.在氧化还原气氛下,推导M2O5晶体形成富金属和缺金属氧化物缺陷浓度与氧 分压的关系。 【答案】(①)富金属氧化物 缺陷方程:M货+o6=M+5C+0,(gs: 平衡常数:K'=M]n 电中性条件:n=5印M 缺陷与温度的关系:n=5M]=(5K')/p62 (②)缺金属氧化物 缺陷方程: 0.=05++ 平衡常数:K'=lppo5
− 118 − A 作业习题汇总 【答案】2* P + a+2P3 = 2* × * + 5P× P + 2a+# hB + V •• P. 14.请写出 LaMnO3 中产生的类似于 Schottky 缺陷的点缺陷方程,其中阳离子空 位只出现在 La 的格位. 【答案】2G × G + 3P× P = 2V ### G + 3V •• P + G 2P3(bQHB/). 15.(1)写出 MO 掺杂 M2O3 的缺陷方程,其中掺杂缺陷通过氧空位电荷平衡. (2)写出在存在水蒸气的情况下,晶体中的氧空位被消除的缺陷方程. (3)写出在存在水蒸气的情况下,MO 掺杂 M2O3 的缺陷方程,其掺杂缺陷通过掺 杂氢的缺陷电荷平衡.同时观察三个缺陷方程间的关系. 【答案】(1)2JHP = 2JH# J + V •• P + 2P× P; (2)>2P(; b) + V •• P + P× P = 2P>• P; (3)2JHP + >2P(; b)=2JH# J + 2P>• P + P× P; 可见,(1) + (2) = (3). 16.写出 CaF2 掺杂 CaO 的缺陷方程,其中 F 取代 O,CaO 中的主要的缺陷为 Schottky 缺陷. 【答案】* 62 = 26• P + * × * + V ## * 或 * 62 + V •• P = 26• P + * × * . 17. 推导 M2O5 晶体形成 Schottky 和 Frenkel 缺陷时缺陷浓度与温度的关系. 【答案】(1)Schottky 缺陷 缺陷方程:0=2V ##### J + 5V •• P; 平衡常数:K# S = [V ##### J ] 2[V •• P] 5; 电中性条件:5[V ##### J ] = 2[V •• P]; 缺陷与温度的关系:[V •• P] = 5 2 [V ##### J ] = %25 4 K# S &1/7 = K#% S 2tT % −∆H% S 7RT & . (2)Frenkel 缺陷 缺陷方程:J× J = V ##### J + J••••• i ; 平衡常数:K# F = [V ##### J ][J••••• i ]; 电中性条件:[V ##### J ]=[J••••• i ]; 缺陷与温度的关系:[V ##### J ]=[J••••• i ]=(K# F ) 1/2 = K#% F 2tT % −∆H% S 2RT & . 18. 在氧化还原气氛下,推导 M2O5 晶体形成富金属和缺金属氧化物缺陷浓度与氧 分压的关系. 【答案】(1) 富金属氧化物 缺陷方程:J× J + 2 5 P× P = J••••• i + 5e# + 5 4 P2(; b); 平衡常数:K# = [J••••• i ]n5p 4/5 Pk ; 电中性条件:n = 5[J••••• i ]; 缺陷与温度的关系:n = 5[J••••• i ] = (5K# )1/6p −4/25 Pk . (2) 缺金属氧化物 缺陷方程:5 4 P2(; b) = V ##### J + 2 5 P× P + 5h• +; 平衡常数:K# = [V ##### J ]p5p −4/5 Pk ;

-119- 电中性条件:p=5 缺陷与温度的关系:p=5Y=(5/6p2 19.一种M0晶体,在还原或氧化气氛下,分别可以形成缺氧MO1和缺金属 M1✉0氧化物,计算不同氧分压下的各种缺陷与氧分压的关系,并画图(假设在中间氧 分压区肖特基缺陷为主要缺陷). 【答案】缺陷方程、平衡常数和电中性条件: 06=VG+2+0a(gs)K1=[Volnpo: 0a(gas)=V+2+08K2=[ViMlppo!2 0=+6→Ka=[V6 n+2=p+2[V6. 低氧分压gn=2ax狼Px阳x (2)高氧分压区,p=2xPO ,nxP6,阳xP (3)中间氧分压区,K=阳x,nG 、1 log[D] 1 log Po2→ 图A.4第3题的Brouwer图 20.推导恒定浓度下M20或Mh2O3掺杂M1+0氧化物的缺陷浓度与氧分压的 关系 【答案】缺陷方程:M+08=M+2e+02(gas),K1=Mn2p022. (1)M2O掺杂M1+zO形成M: 低氧分压:n=2MxPO/,M浓度恒定不变 高氧分压:M:=2且浓度恒定不变,nxp6 (2)M,O,掺杂M+.0形成: 低氧分压:n=2MxPO,Mhu浓度恒定不变 高氧分压:n=Md且浓度恒定不变,Mx6 21.推导可以缺氧和缺金属的MO,氧化物的高价(MhO2)掺杂的缺陷浓度与氧 分压的关系图,掺杂缺陷为恒定浓度掺杂,对于电子缺陷(平衡常数K)和Schottky 缺陷(平衡常数K),K:≥K,所产生的缺陷均完全电离
− 119 − 电中性条件:p = 5[V ##### J ]; 缺陷与温度的关系:p = 5[V ##### J ] = (5K# )1/6p 4/25 Pk . 19. 一种 MO 晶体,在还原或氧化气氛下,分别可以形成缺氧 MO1ɢx 和缺金属 M1ɢxO 氧化物,计算不同氧分压下的各种缺陷与氧分压的关系,并画图(假设在中间氧 分压区肖特基缺陷为主要缺陷). 【答案】缺陷方程、平衡常数和电中性条件: P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , 1 2 P2(; b) = V ## J + 2h• + P× P ⇒ K2 = [V ## J]p2 p −1/2 Pk , 0 = V ## J + V •• P ⇒ K3 = [V ## J][V •• P], n + 2[V ## J] = p + 2[V •• P]. (1)低氧分压区,n = 2[V •• P] ∝ p −1/6 Pk ,p ∝ p 1/6 Pk ,[V ## J] ∝ p 1/6 Pk ; (2)高氧分压区,p = 2[V ## J] ∝ p −1/6 Pk ,n ∝ p −1/6 Pk ,[V •• P] ∝ p −1/6 Pk ; (3)中间氧分压区,[V ## J]=[V •• P] ∝ p 1/2 Pk ,n ∝ p −1/4 Pk ,p ∝ p 1/4 Pk . 图 A.4 第 3 题的 Brouwer 图 20. 推导恒定浓度下 Ml2O 或 Mh2O3 掺杂 M1+xO 氧化物的缺陷浓度与氧分压的 关系. 【答案】缺陷方程:J× J + P× P = J•• i + 2e# + 1 2P2(; b), K1 = [J•• i ]n2pPk 1/2. (1)Ml2O 掺杂 M1+xO 形成 Ml# J: 低氧分压:n = 2[J•• i ] ∝ p −1/6 Pk ,Ml# J 浓度恒定不变; 高氧分压:Ml# J = 2[J•• i ] 且浓度恒定不变,n ∝ p −1/4 Pk . (2)Mh2O3 掺杂 M1+xO 形成 Mh• J: 低氧分压:n = 2[J•• i ] ∝ p −1/6 Pk ,Mh• J 浓度恒定不变; 高氧分压:n = [J?• J] 且浓度恒定不变,[J•• i ] ∝ p −1/2 Pk . 21. 推导可以缺氧和缺金属的 M2O3 氧化物的高价 (MhO2) 掺杂的缺陷浓度与氧 分压的关系图,掺杂缺陷为恒定浓度掺杂,对于电子缺陷(平衡常数 Ki)和 Schottky 缺陷(平衡常数 Ks),Ki & Ks,所产生的缺陷均完全电离.
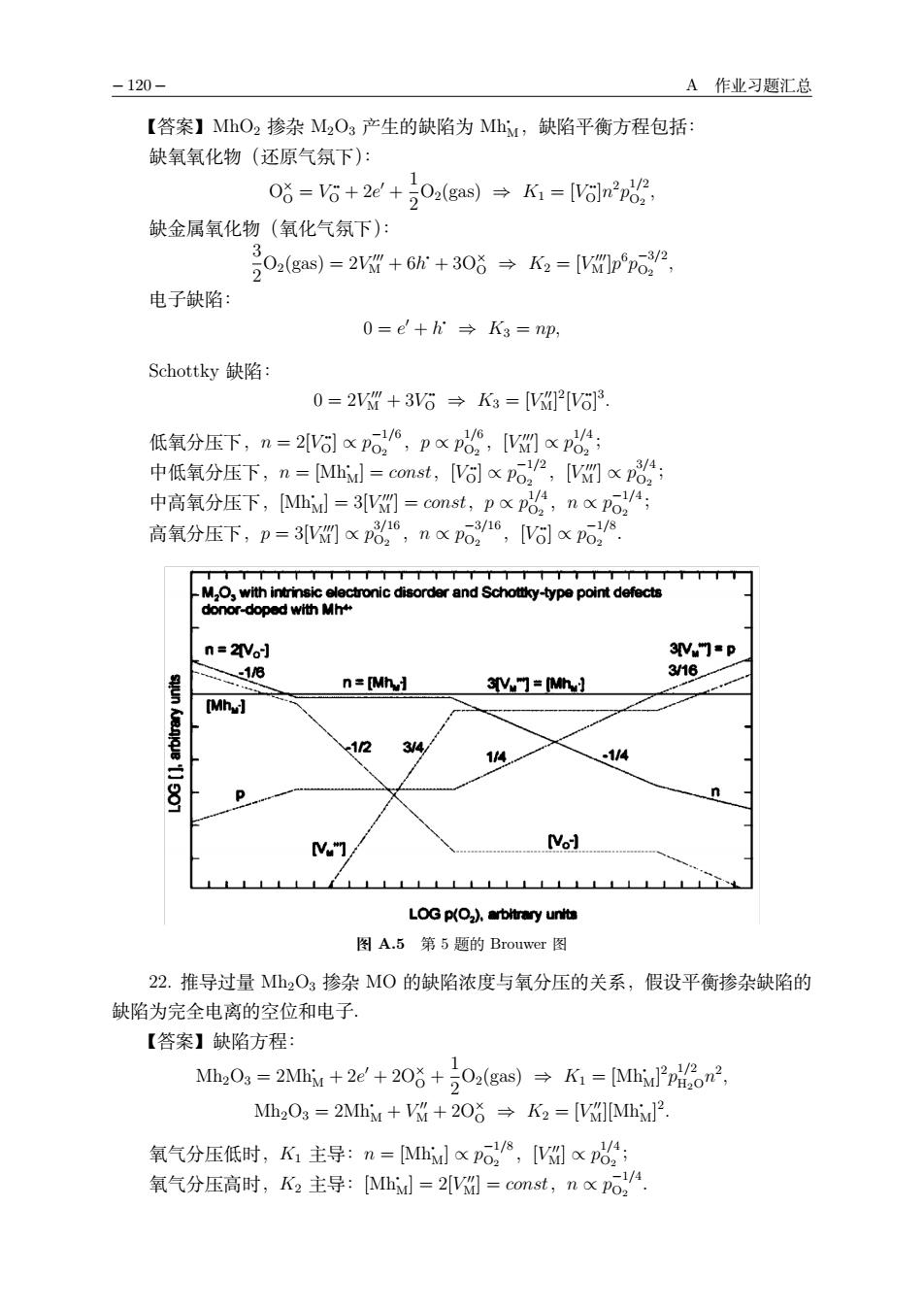
-120 A作业习题汇总 【答案】MhO2掺杂MOg产生的缺陷为MhM,缺陷平衡方程包括: 缺氧氧化物(还原气氛下): 06=6+2W+0,(gas)→K1=6nn 缺金属氧化物(氧化气氛下): 2Oa(gas)=2V+6+308K3=[Vpo2 电子缺陷: 0=e+→Kg=np, Schottky缺陷 0=2VW+3V6→K3=V[V68 低氧分压下,n=2V%lxpo2,nx,[x 中低氧分压下,n=Ml=const,%xP6,x8 附 M.nchoy-yppoint donor-doped wit世Mhm =2V% n=[Mh] 3Y门=MhH [Mh] 12 3/4 14 14 0 [Vol LOG p().arbitrary units 图A.5第5题的Brouwer图 22.推导过量Mh2O3掺杂M0的缺陷浓度与氧分压的关系,假设平衡掺杂缺陷的 缺陷为完全电离的空位和电子 【答案】缺陷方程: M,0=2M+2E+206+202(ga)→K=uP2, Mh2Os=2Mh++2O答→K2=[IMh2 氧气分压低时,K1主导:n=Mhitpo,州x: 氧气分压高时,K,主导:A=2图=const,nxP6
− 120 − A 作业习题汇总 【答案】MhO2 掺杂 M2O3 产生的缺陷为 Mh• J,缺陷平衡方程包括: 缺氧氧化物(还原气氛下): P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , 缺金属氧化物(氧化气氛下): 3 2 P2(; b)=2V ### J + 6h• + 3P× P ⇒ K2 = [V ### J ]p6 p −3/2 Pk , 电子缺陷: 0 = e# + h• ⇒ K3 = np, Schottky 缺陷: 0=2V ### J + 3V •• P ⇒ K3 = [V ## J] 2 [V •• P] 3 . 低氧分压下,n = 2[V •• P] ∝ p −1/6 Pk ,p ∝ p 1/6 Pk ,[V ### J ] ∝ p 1/4 Pk ; 中低氧分压下,n = [J?• J] = const,[V •• P] ∝ p −1/2 Pk ,[V ### J ] ∝ p 3/4 Pk ; 中高氧分压下,[J?• J] = 3[V ### J ] = const,p ∝ p 1/4 Pk ,n ∝ p −1/4 Pk ; 高氧分压下,p = 3[V ### J ] ∝ p 3/16 Pk ,n ∝ p −3/16 Pk ,[V •• P] ∝ p −1/8 Pk . 图 A.5 第 5 题的 Brouwer 图 22. 推导过量 Mh2O3 掺杂 MO 的缺陷浓度与氧分压的关系,假设平衡掺杂缺陷的 缺陷为完全电离的空位和电子. 【答案】缺陷方程: J?2P3 = 2J?• J + 2e# + 2P× P + 1 2 P2(; b) ⇒ K1 = [J?• J] 2 p 1/2 >kPn2 , J?2P3 = 2J?• J + V ## J + 2P× P ⇒ K2 = [V ## J][J?• J] 2 . 氧气分压低时,K1 主导:n = [J?• J] ∝ p −1/8 Pk ,[V ## J] ∝ p 1/4 Pk ; 氧气分压高时,K2 主导:[J?• J] = 2[V ## J] = const,n ∝ p −1/4 Pk .

-121 23.推导氢掺杂对缺氧化合物MO1z的缺陷浓度与水蒸气分压的关系 【答案】缺陷方程: Oǒ=6+2E+0(gas→K1=Ign2p0, H2O(gas)+206=20Ho +2e+02(gas)K2 [OHoln2poPio 低水装气分压下:n=2V哈xp66,OHx 高水蒸气分压:n=[Olx,glxp6 24.根据Bond Valence理论计算NaO晶体的其晶胞参数, 【答案】由S=(R/R)N=1/4,得R=2.24,因此dy=Rg-bns=2.75A.Na 原子在1/8晶胞的体心,因此a=6.36A. 25.借助剑桥大学关于Ellingham图的网站,回答下列问题 (1)The Ellingham diagram shows values of which thermodynamic quantity as a function of temperature? a.Standard electrode voltage; b.Standard free energy change of reaction; c.Partial pressure of gas; d.Enthalpy change of reaction. (2)For a closed system at equilibrium at a temperature T,which of the following statements are true? a.△G=0: b.△G9=0: C.AH =TAS d.△S=0. (3)Why are the slopes of many of the lines on the Ellingham diagram almost identical? a.Most reactions involve the elimination of one mole of gas,so there is a similar standard enthalpy change of reaction. b.Most reactions involve the elimination of one mole of gas,so there is a similar standard entropy change of reaction. c.The activity of most of the metals is the same d.The partial pressure of the reacting gas is the same for all reactions. (4)What thermodynamic quantity does the intercept at T=0K for any standard free energy vs T line signify? a.The approximate value of the standard entropy change; b.The approximate value of the standard enthalpy change c.The equilibrium constant for the oxidation reaction; d.Heat capacity of the oxide
− 121 − 23. 推导氢掺杂对缺氧化合物 MO1ɢx 的缺陷浓度与水蒸气分压的关系. 【答案】缺陷方程: P× P = V •• P + 2e# + 1 2 P2(; b) ⇒ K1 = [V •• P]n2 p 1/2 Pk , >2P(; b)+2P× P = 2P>• P + 2e# + 1 2 P2(; b) ⇒ K2 = [P>• P] 2 n2 p 1/2 Pk p−1 >kP 低水蒸气分压下:n = 2[V •• P] ∝ p −1/6 Pk ,[P>• P] ∝ p 1/2 Pk ; 高水蒸气分压:n = [P>• P] ∝ p 1/4 Pk ,[V •• P] ∝ p −1/2 Pk . 24. 根据 Bond Valence 理论计算 Na2O 晶体的其晶胞参数. 【答案】由 sij = (R0/R)N = 1/4,得 R = 2.24,因此 dij = Rij −bHMsij = 2.75Å.Na 原子在 1/8 晶胞的体心,因此 a = 6.36Å. 25. 借助剑桥大学关于 Ellingham 图的网站,回答下列问题: (1) The Ellingham diagram shows values of which thermodynamic quantity as a function of temperature? a. Standard electrode voltage; b. Standard free energy change of reaction; c. Partial pressure of gas; d. Enthalpy change of reaction. (2) For a closed system at equilibrium at a temperature T, which of the following statements are true? a. ∆G = 0; b. ∆G% = 0; c. ∆H = T ∆S; d. ∆S = 0. (3) Why are the slopes of many of the lines on the Ellingham diagram almost identical? a. Most reactions involve the elimination of one mole of gas, so there is a similar standard enthalpy change of reaction. b. Most reactions involve the elimination of one mole of gas, so there is a similar standard entropy change of reaction. c. The activity of most of the metals is the same. d. The partial pressure of the reacting gas is the same for all reactions. (4) What thermodynamic quantity does the intercept at T=0 K for any standard free energy vs T line signify? a. The approximate value of the standard entropy change; b. The approximate value of the standard enthalpy change; c. The equilibrium constant for the oxidation reaction; d. Heat capacity of the oxide

-122 A作业习题汇总 (5)What is the decomposition temperature (to the nearest 50K)for Ag20?(This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a.460K b.500K c.540K d.620K (6)What is the decomposition temperature(to the nearest 50 K)for PdO?(This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a.1050K b.1100K c.1150K d.1200k (7)Which of the following elements can be used to produce Cr from Cr203 at 1200K?(This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a.Mg b.Fe c.Co d.Al 【答案】(1)b;(2)ac;(3)b;(4)b;(5)a(462K);(6)c(1139K);(7)ad (比较曲线的上下关系). 26.如何从Ellingham图中查出温度T时某金属氧化物与H2-H20平衡体系的 H2/HzO摩尔比(或p(H2)/P(H2O)的方法,并推导其理论根据. 【答案】平衡时,△G=△G9+T+lnK. M+O2-→MO2,△G1, 2H2+02-→2H20,△G2 2H2+MO2-→M+2H20,△G3=△G2-△G. 由平衡时△G=0得 △G9=AG号-△GR=mmpL P(H2O) 所以作△G写~T得图,根据斜率求得, 27.(1)以固-液溶解反应Fe-HS04为例,建立整体反应速率与各步骤反应速率间 的定量关系(假设固液界面的反应为二级反应),并根据结果讨论其中一个步骤为决速 步骤时该整体反应速率的简化计算公式· (2)推导反应物分别是铁板和球形铁粉情形时铁的质量与时间的关系式. 【答案】(1)反应的进行按照两个串联的过程完成:H+从H2SO1溶液体相(H+浓 度为C)穿过厚度为6的边界层扩散至F板表面(固液界面,H+浓度为C)和在此 界面上发生析氢反应 k1A(C-C:)=k2AC2
− 122 − A 作业习题汇总 (5) What is the decomposition temperature (to the nearest 50 K) for Ag2O? (This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a. 460K b. 500K c. 540K d. 620K (6) What is the decomposition temperature (to the nearest 50 K) for PdO? (This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a. 1050K b. 1100K c. 1150K d. 1200K (7) Which of the following elements can be used to produce Cr from Cr2O3 at 1200K? (This question should be completed with the help of the interactive Ellingham diagram included with this TLP). a. Mg b. Fe c. Co d. Al 【答案】(1)b;(2)ac;(3)b;(4)b;(5)a(462K);(6)c(1139K);(7)ad (比较曲线的上下关系). 26. 如何从 Ellingham 图中查出温度 T 时某金属氧化物与 H2−H2O 平衡体系的 H2/H2O 摩尔比(或 p(H2)/P(H2O))的方法,并推导其理论根据. 【答案】平衡时,∆G = ∆G% + RT + HMK. J + Pk −−→ JPk, ∆G1, k >k + Pk −−→ k >kP, ∆G2, k >k + JPk −−→ J + k >kP, ∆G3 = ∆G2 − ∆G1. 由平衡时 ∆G = 0 得 ∆G% 3 = ∆G% 2 − ∆G% 1 = RTHM p(>k) p(>kP) 所以作 ∆G% 3 ∼ T 得图,根据斜率求得 p(>k) p(>kP) . 27.(1)以固-液溶解反应 Fe-H2SO4 为例,建立整体反应速率与各步骤反应速率间 的定量关系(假设固液界面的反应为二级反应),并根据结果讨论其中一个步骤为决速 步骤时该整体反应速率的简化计算公式. (2)推导反应物分别是铁板和球形铁粉情形时铁的质量与时间的关系式. 【答案】(1)反应的进行按照两个串联的过程完成:H+ 从 H2SO4 溶液体相(H+ 浓 度为 C)穿过厚度为 δ 的边界层扩散至 Fe 板表面(固-液界面,H+ 浓度为 Ci)和在此 界面上发生析氢反应. k1A(C − Ci) = k2AC2 i