
实验七 蛋白质含量的测定 衡量食品的营养成分时,要测定蛋白质含量,但由于蛋白质组成及其性质的 复杂性,在食品分析中,通常用食品的总氮量表示,蛋白质是食品含氮物质的主 要形式,每一蛋白质都有其恒定的含氮量,用实验方法求得某样品中的含氮量后, 通过一定的换算系数。即可计算该样品的蛋白质含量。 一般食品蛋白质含氮量为 l0%如肉、蛋、豌豆、玉米等,其换算系数为 6.25, 小麦取 5.70,大米 5.95、乳制品 6.38、大豆 5.17,动物胶 5.55。 一、目的与要求: 掌握微量凯氏法测定蛋白质总氮量的原理及操作技术。包括样品的消 化,蒸馏吸收及滴定与含氮量的计算。 二、原理: 凯氏定氮法:食品经加硫酸消化使蛋白质分解,其中氮素与硫酸化合成硫酸 铵。然后加碱蒸馏使氨游离,用硼酸液吸收后,再用盐酸或硫酸滴定根据盐酸消 耗量,再乘以一定的数值即为蛋白含量,其化学反应式如下。 ( 1 ) 2NH2(CH2)2COOH+13H2S04 (NH4)2S04+6C02+12S02+ 16H2 (2)(NH4)2SO4+2NAOH-2NH2+2H2O+NA2SO4 (3)2NH3+4H3BO3-(NH4)2B4O7+5H2O (4) (NH4)2B407+H2S04+5H20-(NH4)9SO4+4H2BO2 三、试剂与仪器: 1、硫酸钾 2、硫酸铜 3、硫酸 4、2%硼酸溶液 5、40%氢氧化钠溶液 6、混合指示剂:把溶解于 95%乙醇的 0.l%溴甲酚绿溶液 10 毫升和溶于 95% 乙醇的 0.l%甲基红溶液 2 毫升混合而成. 7、0.OINHCL 标准溶液或 0.01N 硫酸标准溶液. 8、凯氏微量定氮仪一套。 9、定氮瓶 100m1 或 50ml 一只
实验七 蛋白质含量的测定 衡量食品的营养成分时,要测定蛋白质含量,但由于蛋白质组成及其性质的 复杂性,在食品分析中,通常用食品的总氮量表示,蛋白质是食品含氮物质的主 要形式,每一蛋白质都有其恒定的含氮量,用实验方法求得某样品中的含氮量后, 通过一定的换算系数。即可计算该样品的蛋白质含量。 一般食品蛋白质含氮量为 l0%如肉、蛋、豌豆、玉米等,其换算系数为 6.25, 小麦取 5.70,大米 5.95、乳制品 6.38、大豆 5.17,动物胶 5.55。 一、目的与要求: 掌握微量凯氏法测定蛋白质总氮量的原理及操作技术。包括样品的消 化,蒸馏吸收及滴定与含氮量的计算。 二、原理: 凯氏定氮法:食品经加硫酸消化使蛋白质分解,其中氮素与硫酸化合成硫酸 铵。然后加碱蒸馏使氨游离,用硼酸液吸收后,再用盐酸或硫酸滴定根据盐酸消 耗量,再乘以一定的数值即为蛋白含量,其化学反应式如下。 ( 1 ) 2NH2(CH2)2COOH+13H2S04 (NH4)2S04+6C02+12S02+ 16H2 (2)(NH4)2SO4+2NAOH-2NH2+2H2O+NA2SO4 (3)2NH3+4H3BO3-(NH4)2B4O7+5H2O (4) (NH4)2B407+H2S04+5H20-(NH4)9SO4+4H2BO2 三、试剂与仪器: 1、硫酸钾 2、硫酸铜 3、硫酸 4、2%硼酸溶液 5、40%氢氧化钠溶液 6、混合指示剂:把溶解于 95%乙醇的 0.l%溴甲酚绿溶液 10 毫升和溶于 95% 乙醇的 0.l%甲基红溶液 2 毫升混合而成. 7、0.OINHCL 标准溶液或 0.01N 硫酸标准溶液. 8、凯氏微量定氮仪一套。 9、定氮瓶 100m1 或 50ml 一只
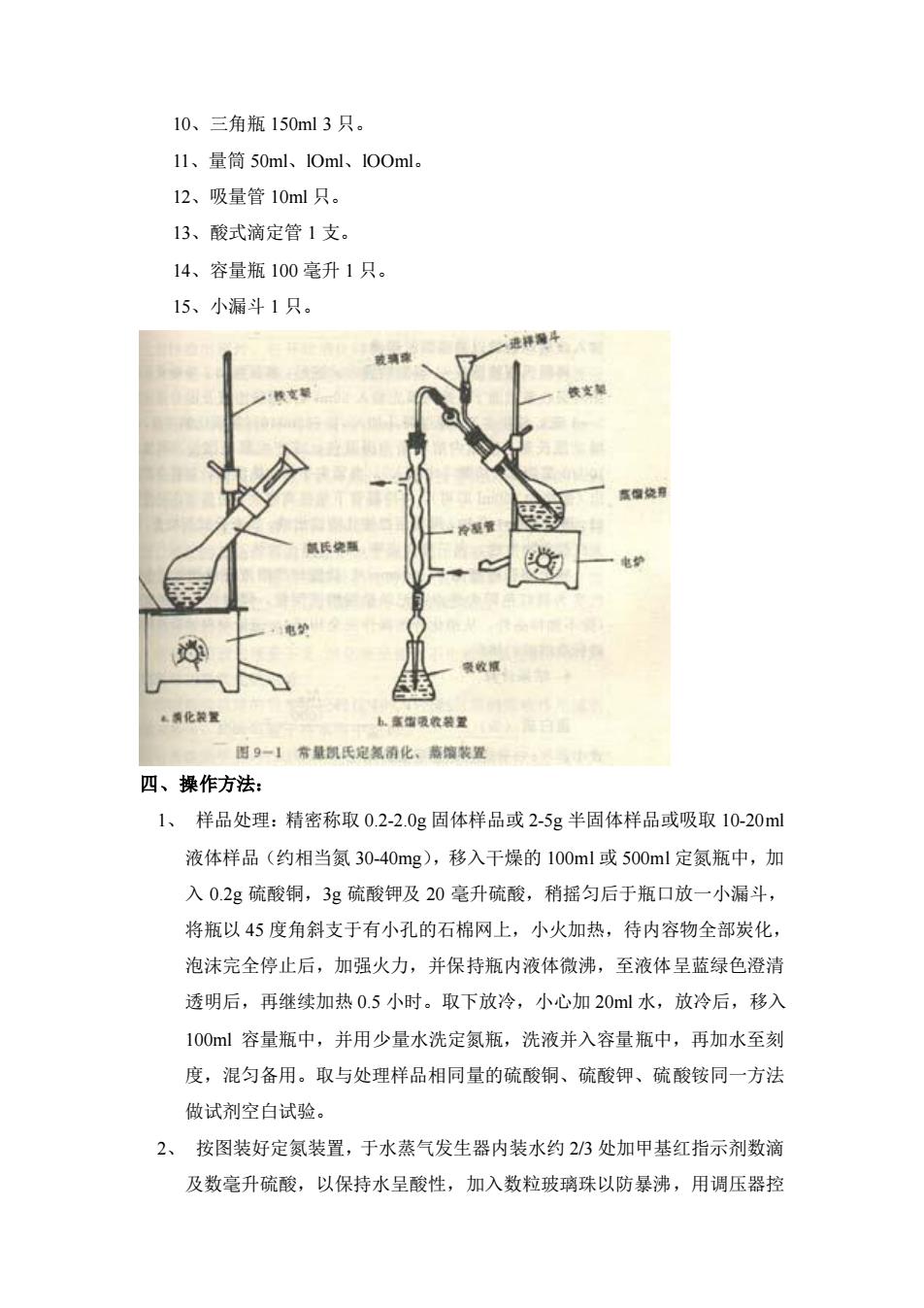
10、三角瓶 150ml 3 只。 11、量筒 50ml、lOml、lOOml。 12、吸量管 10ml 只。 13、酸式滴定管 1 支。 14、容量瓶 100 毫升 1 只。 15、小漏斗 1 只。 四、操作方法: 1、 样品处理:精密称取 0.2-2.0g 固体样品或 2-5g 半固体样品或吸取 10-20ml 液体样品(约相当氮 30-40mg),移入干燥的 100ml 或 500ml 定氮瓶中,加 入 0.2g 硫酸铜,3g 硫酸钾及 20 毫升硫酸,稍摇匀后于瓶口放一小漏斗, 将瓶以 45 度角斜支于有小孔的石棉网上,小火加热,待内容物全部炭化, 泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清 透明后,再继续加热 0.5 小时。取下放冷,小心加 20ml 水,放冷后,移入 100ml 容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻 度,混匀备用。取与处理样品相同量的硫酸铜、硫酸钾、硫酸铵同一方法 做试剂空白试验。 2、 按图装好定氮装置,于水蒸气发生器内装水约 2/3 处加甲基红指示剂数滴 及数毫升硫酸,以保持水呈酸性,加入数粒玻璃珠以防暴沸,用调压器控
10、三角瓶 150ml 3 只。 11、量筒 50ml、lOml、lOOml。 12、吸量管 10ml 只。 13、酸式滴定管 1 支。 14、容量瓶 100 毫升 1 只。 15、小漏斗 1 只。 四、操作方法: 1、 样品处理:精密称取 0.2-2.0g 固体样品或 2-5g 半固体样品或吸取 10-20ml 液体样品(约相当氮 30-40mg),移入干燥的 100ml 或 500ml 定氮瓶中,加 入 0.2g 硫酸铜,3g 硫酸钾及 20 毫升硫酸,稍摇匀后于瓶口放一小漏斗, 将瓶以 45 度角斜支于有小孔的石棉网上,小火加热,待内容物全部炭化, 泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清 透明后,再继续加热 0.5 小时。取下放冷,小心加 20ml 水,放冷后,移入 100ml 容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻 度,混匀备用。取与处理样品相同量的硫酸铜、硫酸钾、硫酸铵同一方法 做试剂空白试验。 2、 按图装好定氮装置,于水蒸气发生器内装水约 2/3 处加甲基红指示剂数滴 及数毫升硫酸,以保持水呈酸性,加入数粒玻璃珠以防暴沸,用调压器控

制,加热煮沸水蒸气发生瓶内的水。 3、 想接收瓶内加入 10ml 2%硼酸溶液及混合指示剂 1 滴,并使冷凝管的下端 插入液面下,吸取 10.0ml 样品消化液由小玻璃杯流入反应室,并以 10ml 水洗涤小烧杯使流入反应室内,塞紧小玻璃杯的棒状玻璃塞。将 10ml 40% 氢氧化钠溶液倒入小玻璃杯,提起玻璃塞使其缓慢流入反应室,立即将玻 璃盖塞紧,并加水于小玻璃杯以防漏气。夹紧螺旋夹,开始蒸馏,蒸气通 入反应室使氨通过冷凝管而进入接收瓶内,蒸馏 5min。移动接收瓶,使冷 凝管下端离开液皿,再蒸馏 1min,然后用少量水冲洗冷凝管下端外部。取 下接收瓶,以 0.01N 硫酸或 0.01N 盐酸标准溶液定至灰色或蓝紫色为终点。 同时吸取 10.0ml 试剂空白消化液按 3 操作。 计算: X:样品中蛋白质的含量,g; V1:样品消耗硫酸或盐酸标准液的体积,ml; V2:试剂空白消耗硫酸或盐酸标准溶液的体积,ml; N:硫酸或盐酸标准溶液的当量浓度; 0.014:1N 硫酸或盐酸标准溶液 1ml 相当于氮克数; m:样品的质量(体积),g(ml); F:氮换算为蛋白质的系数。 注: (1) 样品应是均匀的,固体样品应预先研细混匀,液体样品应振摇 或搅拌均匀。 (2) 样品放入定氮瓶内时,不要沾附颈上,万一沾附可用少量水冲 下,以免被检样消化不完全,结果偏低。 (V1-V2)*N*0.014 X =- +F*100 m*(10/100)
制,加热煮沸水蒸气发生瓶内的水。 3、 想接收瓶内加入 10ml 2%硼酸溶液及混合指示剂 1 滴,并使冷凝管的下端 插入液面下,吸取 10.0ml 样品消化液由小玻璃杯流入反应室,并以 10ml 水洗涤小烧杯使流入反应室内,塞紧小玻璃杯的棒状玻璃塞。将 10ml 40% 氢氧化钠溶液倒入小玻璃杯,提起玻璃塞使其缓慢流入反应室,立即将玻 璃盖塞紧,并加水于小玻璃杯以防漏气。夹紧螺旋夹,开始蒸馏,蒸气通 入反应室使氨通过冷凝管而进入接收瓶内,蒸馏 5min。移动接收瓶,使冷 凝管下端离开液皿,再蒸馏 1min,然后用少量水冲洗冷凝管下端外部。取 下接收瓶,以 0.01N 硫酸或 0.01N 盐酸标准溶液定至灰色或蓝紫色为终点。 同时吸取 10.0ml 试剂空白消化液按 3 操作。 计算: X:样品中蛋白质的含量,g; V1:样品消耗硫酸或盐酸标准液的体积,ml; V2:试剂空白消耗硫酸或盐酸标准溶液的体积,ml; N:硫酸或盐酸标准溶液的当量浓度; 0.014:1N 硫酸或盐酸标准溶液 1ml 相当于氮克数; m:样品的质量(体积),g(ml); F:氮换算为蛋白质的系数。 注: (1) 样品应是均匀的,固体样品应预先研细混匀,液体样品应振摇 或搅拌均匀。 (2) 样品放入定氮瓶内时,不要沾附颈上,万一沾附可用少量水冲 下,以免被检样消化不完全,结果偏低。 (V1-V2)*N*0.014 X =- +F*100 m*(10/100)

(3) 消化时如不容易呈透明溶液,可将定氮瓶放冷后,慢慢加入 30% 过氧化氢 2-3ml,促使氧化。 (4) 在整个消化过程中,不要用强火,保持和缓的沸腾,使火力集 中在凯氏瓶底部,以免附在壁上的蛋白质在无硫酸存在的情况下。 使氮有损失。 (5) 如硫酸缺少,过多的硫酸钾会引起氨的损失,这样会形成硫酸 氢钾,而不与氨作用,因此当硫酸过多的被消耗或样品中脂肪含量 过高时,要增加硫酸的量。 (6) 加入硫酸钾的作用为增加溶液的沸点,硫酸铜为催化剂,硫酸 铜在蒸馏时作碱性反应的指示剂。 (7) 混合指示剂在碱性溶液中呈绿色,在中性溶液中呈灰色,在酸 性溶液中呈红色。如果没有溴甲酚绿,可单独使用 0.1%甲基红乙醇 溶液。 (8) 氨是否完全蒸馏出来,可用 PH 试纸试馏出液是否为碱性。 (9) 吸收叶也可以用 0.01 当量的酸代表硼酸,过剩的酸液用 0.01N 碱液滴定,计算时,A 为试剂空白消耗碱液数,B 为样品消耗碱液 数,N 为碱液浓度,其余均相同。 (10) 以硼酸为氨的吸收液,可省去标定碱液的操作,且硼酸的体积要 求并不严格,亦可免去用移液管,操作比较简便。 (11) 向蒸馏瓶中加入浓碱时,往往出现褐色沉淀物,这是由于分解促 进碱与加入的硫酸铜反应,生成氢氧化铜,经加热后又分解生成氧 化 铜 的沉 淀 。有 时 铜离 子与 氨 作用 , 生成 深兰 色 的结 合 物 [Cu(NH3)4] ++
(3) 消化时如不容易呈透明溶液,可将定氮瓶放冷后,慢慢加入 30% 过氧化氢 2-3ml,促使氧化。 (4) 在整个消化过程中,不要用强火,保持和缓的沸腾,使火力集 中在凯氏瓶底部,以免附在壁上的蛋白质在无硫酸存在的情况下。 使氮有损失。 (5) 如硫酸缺少,过多的硫酸钾会引起氨的损失,这样会形成硫酸 氢钾,而不与氨作用,因此当硫酸过多的被消耗或样品中脂肪含量 过高时,要增加硫酸的量。 (6) 加入硫酸钾的作用为增加溶液的沸点,硫酸铜为催化剂,硫酸 铜在蒸馏时作碱性反应的指示剂。 (7) 混合指示剂在碱性溶液中呈绿色,在中性溶液中呈灰色,在酸 性溶液中呈红色。如果没有溴甲酚绿,可单独使用 0.1%甲基红乙醇 溶液。 (8) 氨是否完全蒸馏出来,可用 PH 试纸试馏出液是否为碱性。 (9) 吸收叶也可以用 0.01 当量的酸代表硼酸,过剩的酸液用 0.01N 碱液滴定,计算时,A 为试剂空白消耗碱液数,B 为样品消耗碱液 数,N 为碱液浓度,其余均相同。 (10) 以硼酸为氨的吸收液,可省去标定碱液的操作,且硼酸的体积要 求并不严格,亦可免去用移液管,操作比较简便。 (11) 向蒸馏瓶中加入浓碱时,往往出现褐色沉淀物,这是由于分解促 进碱与加入的硫酸铜反应,生成氢氧化铜,经加热后又分解生成氧 化 铜 的沉 淀 。有 时 铜离 子与 氨 作用 , 生成 深兰 色 的结 合 物 [Cu(NH3)4] ++