
8 O 第六章 ”气体动理论基础 §61 平衡态温度理想气体状态方程 §6-2 理想气体压强公式 S6-3 温度的统汁解释 §6-4 能量均分定理 理想气体的内能 §6-5 麦克斯韦分子速率分布定律 *§6-6 玻耳兹曼分布律 §6=7 分子的平均碰撞次数和平均自由程 米§6-8©气体内的输运过程 首页上页下页退出
首 页 上 页 下 页 退 出 1 第六章 气体动理论基础 §6-1 平衡态 温度 理想气体状态方程 §6-2 理想气体压强公式 §6-3 温度的统计解释 §6-4 能量均分定理 理想气体的内能 §6-5 麦克斯韦分子速率分布定律 *§6-6 玻耳兹曼分布律 §6-7 分子的平均碰撞次数和平均自由程 *§6-8 气体内的输运过程

§6-1平衡态 温度理想气体状态方程 6.1.1平衡态 1、热力学系统 由大量微观粒子(分子、原子等微观粒子)所组成的宏观 物体或系统。 ★热力学系统分类 根据系统与外界交换能量或物质的特点,可以分为三种: ()孤立系统一一与外界既无能量交换,又无物质交换的系统 (2)封闭系统一一与外界只有能量交换,但无物质交换的系统 (3)开放系统一一与外界既有能量交换,又有物质交换的系统 2、平衡态 指在不受外界影响(或不变的)的条件下,系统的宏观性 质不随时间变化的状态称热平衡态。 首页上页下页退出
首 页 上 页 下 页 退 出 2 §6-1 平衡态 温度 理想气体状态方程 6.1.1 平衡态 1、热力学系统 ★ 热力学系统分类 根据系统与外界交换能量或物质的特点,可以分为三种: (1) 孤立系统--与外界既无能量交换,又无物质交换的系统 (2) 封闭系统--与外界只有能量交换,但无物质交换的系统 (3) 开放系统--与外界既有能量交换,又有物质交换的系统 由大量微观粒子(分子、原子等微观粒子)所组成的宏观 物体或系统。 2、平衡态 指在不受外界影响(或不变的)的条件下,系统的宏观性 质不随时间变化的状态 称热平衡态

系统在热平衡时,系统内任一宏观体元均处于力学平衡、 热平衡、相平衡中。 ※从微观的角度应理解为动态平衡态 必平衡态是一种是理想概念 ※若在我们所讨论的问题中,气体活动的高度空间不是很 大,即重力加速度随高度的变化可以忽略,则在达热力学平衡 态时,上述宏观量不仅是稳定的(指不随时间变化)还是均匀 的(即不随位置变化)。 ※处于热平衡态时,系统的宏观属性具有确定的值。因此 可以用一些确定的物理量来表征系统的这些宏观属性。用来 描写热平衡态下各种宏观属性的物理量叫系统的宏观参量。 首页上页下页退出
首 页 上 页 下 页 退 出 3 系统在热平衡时,系统内任一宏观体元均处于力学平衡、 热平衡、相平衡中。 ※ 从微观的角度应理解为动态平衡态 ※ 若在我们所讨论的问题中,气体活动的高度空间不是很 大,即重力加速度随高度的变化可以忽略,则在达热力学平衡 态时,上述宏观量不仅是稳定的(指不随时间变化)还是均匀 的(即不随位置变化)。 ※ 平衡态是一种是理想概念 ※ 处于热平衡态时,系统的宏观属性具有确定的值。因此 可以用一些确定的物理量来表征系统的这些宏观属性。用来 描写热平衡态下各种宏观属性的物理量叫系统的宏观参量

我们可以从这些参量中,选取不多的相互独立的几 个物理量作为描述系统热平衡态的参量,叫系统的状态 参量。 主要的参量有:几何参量,力学参量,热学参量, 化学参量,电磁参量;体积V,压强P,热力学温度T, 摩尔数v。 6.1.2温度 1、温度概念 温度是表征物体冷热程度的宏观状态参量。 温度概念的建立是以热平衡为基础的。 首页上页下页退出
首 页 上 页 下 页 退 出 4 我们可以从这些参量中,选取不多的相互独立的几 个物理量作为描述系统热平衡态的参量,叫系统的状态 参量。 主要的参量有:几何参量,力学参量,热学参量, 化学参量,电磁参量; 体积V,压强P,热力学温度T, 摩尔数v。 6.1.2 温度 1、温度概念 温度是表征物体冷热程度的宏观状态参量。 温度概念的建立是以热平衡为基础的
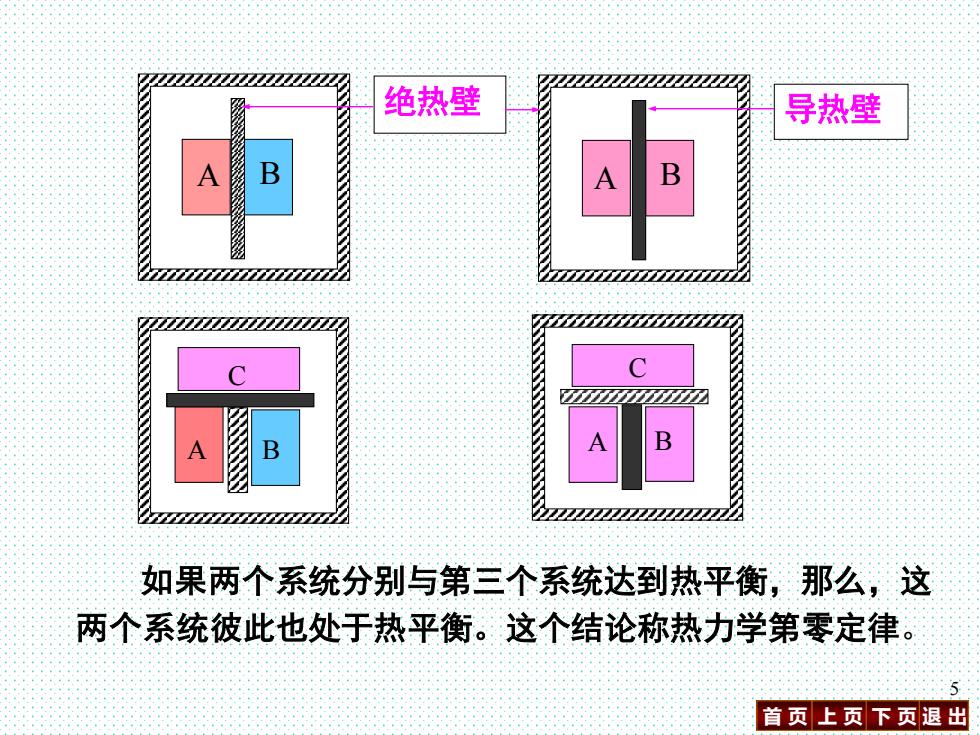
绝热壁 导热壁 A B 如果两个系统分别与第三个系统达到热平衡,那么,这 两个系统彼此也处于热平衡。这个结论称热力学第零定律。 首页上页下页退出
首 页 上 页 下 页 退 出 5 A B A B 绝热壁 导热壁 A B C A B C 如果两个系统分别与第三个系统达到热平衡,那么,这 两个系统彼此也处于热平衡。这个结论称热力学第零定律

处在相互热平衡状态的系统必定拥有某一个共同的物理性 质,我们把描述系统这一共同宏观性质的物理量称为系统的 温度。 2、温标温度计 温度计:即测温的工具。 温度计要能定量表示和测量温度,还需要建立温标一即 温度的数值表示法。 ※主要有三个步骤 其一、要选定一种合适物质(称测温质)的测温特性; 其二、规定测温质的测温特性与温度的依赖关系(线性); 其三、选定温度的标准点(固定点),并把一定间隔的冷 热程度分为若干度。 首页上页下页退出
首 页 上 页 下 页 退 出 6 处在相互热平衡状态的系统必定拥有某一个共同的物理性 质,我们把描述系统这一共同宏观性质的物理量称为系统的 温度 。 2、温标 温度计 温度计要能定量表示和测量温度,还需要建立温标 ──即 温度的数值表示法。 其一、要选定一种合适物质(称测温质)的测温特性; 其二、规定测温质的测温特性与温度的依赖关系(线性); 其三、选定温度的标准点(固定点),并把一定间隔的冷 热程度分为若干度。 ※ 主要有三个步骤 温度计:即测温的工具

※选用不同的测温物质或不同的测温特性,测量同一系统所 得的温度数值,一般情况下并不完全相同。 例如,(一个大气压下) 对水的冰点,华氏温标为32,攝氏温标为0C, 对水的沸点,华氏温标为212F,攝氏温标为100C。 3、热力学温标 一种与测温质和测温特性无关的温标。开尔文(lord Kelvin)在热力学第二定律的基础上建立了这种温标,称热 力学温标。 规定水的三相点(水,冰和水蒸汽平衡共存的状态)为 273.16K。 由热力学温标可导出摄氏温度 T=t+273.15 首页上页下页退出
首 页 上 页 下 页 退 出 7 3、热力学温标 规定水的三相点(水,冰和水蒸汽平衡共存的状态)为 273.16K。 一种与测温质和测温特性无关的温标。开尔文(lord Kelvin)在热力学第二定律的基础上建立了这种温标,称热 力学温标。 例如,(一个大气压下) 对水的冰点,华氏温标为32F0,攝氏温标为0C0 , 对水的沸点,华氏温标为212F0,攝氏温标为100C0 。 由热力学温标可导出摄氏温度 T=t+273.15 ※选用不同的测温物质或不同的测温特性,测量同一系统所 得的温度数值,一般情况下并不完全相同

6.1.3 理想气体状态方程 1、理想气体 从宏观定义:在室温下P不太大P不太高三大实验定律所得结罐想化 从微观定义忽略分子间作用分子间分子与器壁间碰撞视弹性碰撞 2、理想气体的状态方程 热平衡态下,系统各个状态参量之间满足一定的关系,这样 的关系叫系统的状态方程 过程方程 PY PV2 T M 克拉珀龙方程 P= RT Mmol 式中R是气体普适常量,在SI中R=8.31(J-mol-1.K), Mmo是气体的摩尔质量。 首页上页下页退出
首 页 上 页 下 页 退 出 8 6.1.3 理想气体状态方程 1、理想气体 2、理想气体的状态方程 热平衡态下,系统各个状态参量之间满足一定的关系,这样 的关系叫系统的状态方程 。 。 从微观定义:忽略分子间作用力,分子间,分子与器壁间碰撞视为弹性碰撞 从宏观定义:在室温下,ρ不太大,P不太高 ,三大实验定律所得结论理想化 克拉珀龙方程 RT M M PV mol = 式中R是气体普适常量,在SI中 R=8.31 (J·mol-1·K-1 ), Mmol是气体的摩尔质量。 过程方程 2 2 2 1 1 1 T PV T PV =
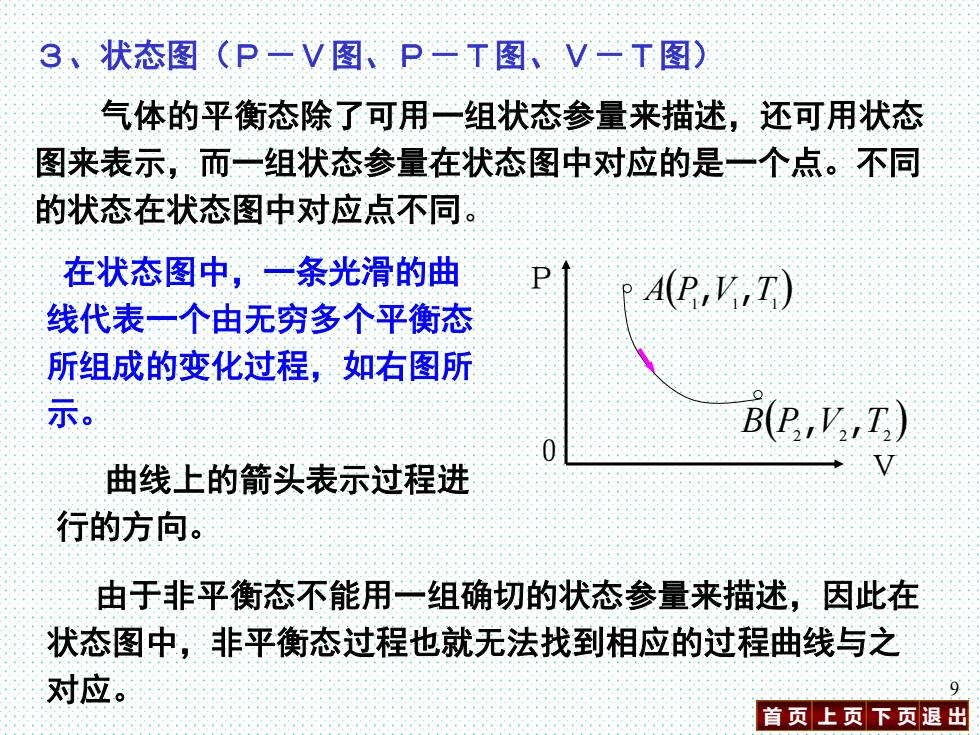
3、状态图(P一V图、P一T图、V一T图) 气体的平衡态除了可用一组状态参量来描述,还可用状态 图来表示,而一组状态参量在状态图中对应的是一个点。不同 的状态在状态图中对应点不同。 在状态图中,一条光滑的曲 P A(P,V,T) 线代表一个由无穷多个平衡态 所组成的变化过程,如右图所 示。 B(C,',I) 曲线上的箭头表示过程进 行的方向。 由于非平衡态不能用一组确切的状态参量来描述,因此在 状态图中,非平衡态过程也就无法找到相应的过程曲线与之 对应。 入 首页上页下页退出
首 页 上 页 下 页 退 出 9 3、状态图(P-V图、P-T图、V-T图) 气体的平衡态除了可用一组状态参量来描述,还可用状态 图来表示,而一组状态参量在状态图中对应的是一个点。不同 的状态在状态图中对应点不同。 在状态图中,一条光滑的曲 线代表一个由无穷多个平衡态 所组成的变化过程,如右图所 示。 ( ) A P1 V1 T1 , , ( ) B P2 V2 T2 , , P 曲线上的箭头表示过程进 0 V 行的方向。 由于非平衡态不能用一组确切的状态参量来描述,因此在 状态图中,非平衡态过程也就无法找到相应的过程曲线与之 对应

§6-2理想气体压强公式 6.2.1分子模型 1、分子可以看作质点。(除特别考虑) 2、除碰撞外,分子之间,分子与器壁不计相互作用力。 3、分子间,分子与器壁间的碰撞是完全弹性的,遵守 动量和能量守恒定律。 即:理想气体分子可看作彼此间无相互作用的遵守 经典力学规律的弹性质点。 10 首页上页下页退出
首 页 上 页 下 页 退 出 10 §6-2 理想气体压强公式 6.2.1 分子模型 3、分子间,分子与器壁间的碰撞是完全弹性的,遵守 动量和能量守恒定律。 即: 理想气体分子可看作彼此间无相互作用的遵守 经典力学规律的弹性质点。 1、分子可以看作质点。(除特别考虑) 2、除碰撞外,分子之间,分子与器壁不计相互作用力