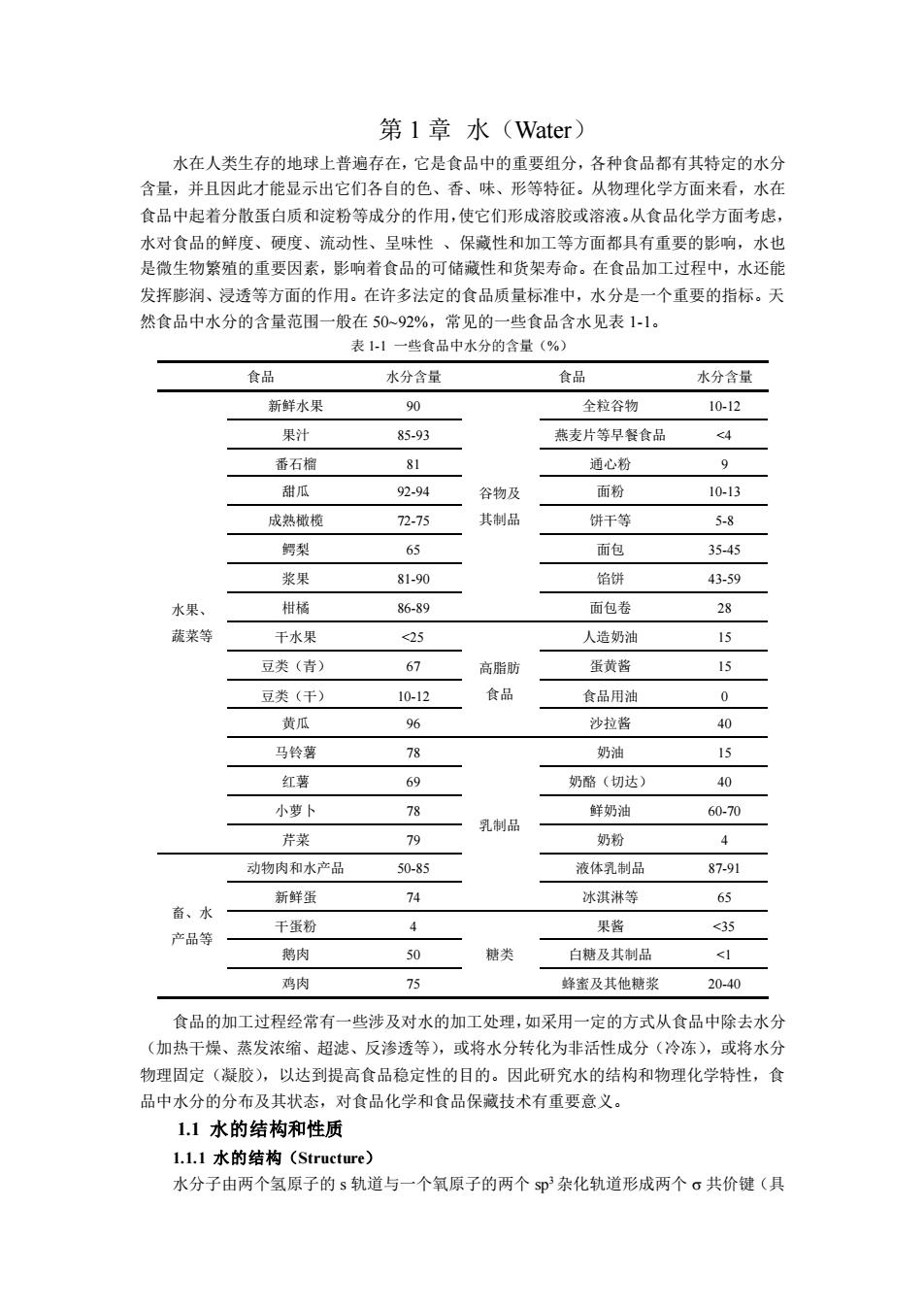
第 1 章 水(Water) 水在人类生存的地球上普遍存在,它是食品中的重要组分,各种食品都有其特定的水分 含量,并且因此才能显示出它们各自的色、香、味、形等特征。从物理化学方面来看,水在 食品中起着分散蛋白质和淀粉等成分的作用,使它们形成溶胶或溶液。从食品化学方面考虑, 水对食品的鲜度、硬度、流动性、呈味性 、保藏性和加工等方面都具有重要的影响,水也 是微生物繁殖的重要因素,影响着食品的可储藏性和货架寿命。在食品加工过程中,水还能 发挥膨润、浸透等方面的作用。在许多法定的食品质量标准中,水分是一个重要的指标。天 然食品中水分的含量范围一般在 50~92%,常见的一些食品含水见表 1-1。 表 1-1 一些食品中水分的含量(%) 食品 水分含量 食品 水分含量 水果、 蔬菜等 新鲜水果 90 谷物及 其制品 全粒谷物 10-12 果汁 85-93 燕麦片等早餐食品 <4 番石榴 81 通心粉 9 甜瓜 92-94 面粉 10-13 成熟橄榄 72-75 饼干等 5-8 鳄梨 65 面包 35-45 浆果 81-90 馅饼 43-59 柑橘 86-89 面包卷 28 干水果 <25 高脂肪 食品 人造奶油 15 豆类(青) 67 蛋黄酱 15 豆类(干) 10-12 食品用油 0 黄瓜 96 沙拉酱 40 马铃薯 78 乳制品 奶油 15 红薯 69 奶酪(切达) 40 小萝卜 78 鲜奶油 60-70 芹菜 79 奶粉 4 畜、水 产品等 动物肉和水产品 50-85 液体乳制品 87-91 新鲜蛋 74 冰淇淋等 65 干蛋粉 4 糖类 果酱 <35 鹅肉 50 白糖及其制品 <1 鸡肉 75 蜂蜜及其他糖浆 20-40 食品的加工过程经常有一些涉及对水的加工处理,如采用一定的方式从食品中除去水分 (加热干燥、蒸发浓缩、超滤、反渗透等),或将水分转化为非活性成分(冷冻),或将水分 物理固定(凝胶),以达到提高食品稳定性的目的。因此研究水的结构和物理化学特性,食 品中水分的分布及其状态,对食品化学和食品保藏技术有重要意义。 1.1 水的结构和性质 1.1.1 水的结构(Structure) 水分子由两个氢原子的 s 轨道与一个氧原子的两个 sp3 杂化轨道形成两个 共价键(具
第 1 章 水(Water) 水在人类生存的地球上普遍存在,它是食品中的重要组分,各种食品都有其特定的水分 含量,并且因此才能显示出它们各自的色、香、味、形等特征。从物理化学方面来看,水在 食品中起着分散蛋白质和淀粉等成分的作用,使它们形成溶胶或溶液。从食品化学方面考虑, 水对食品的鲜度、硬度、流动性、呈味性 、保藏性和加工等方面都具有重要的影响,水也 是微生物繁殖的重要因素,影响着食品的可储藏性和货架寿命。在食品加工过程中,水还能 发挥膨润、浸透等方面的作用。在许多法定的食品质量标准中,水分是一个重要的指标。天 然食品中水分的含量范围一般在 50~92%,常见的一些食品含水见表 1-1。 表 1-1 一些食品中水分的含量(%) 食品 水分含量 食品 水分含量 水果、 蔬菜等 新鲜水果 90 谷物及 其制品 全粒谷物 10-12 果汁 85-93 燕麦片等早餐食品 <4 番石榴 81 通心粉 9 甜瓜 92-94 面粉 10-13 成熟橄榄 72-75 饼干等 5-8 鳄梨 65 面包 35-45 浆果 81-90 馅饼 43-59 柑橘 86-89 面包卷 28 干水果 <25 高脂肪 食品 人造奶油 15 豆类(青) 67 蛋黄酱 15 豆类(干) 10-12 食品用油 0 黄瓜 96 沙拉酱 40 马铃薯 78 乳制品 奶油 15 红薯 69 奶酪(切达) 40 小萝卜 78 鲜奶油 60-70 芹菜 79 奶粉 4 畜、水 产品等 动物肉和水产品 50-85 液体乳制品 87-91 新鲜蛋 74 冰淇淋等 65 干蛋粉 4 糖类 果酱 <35 鹅肉 50 白糖及其制品 <1 鸡肉 75 蜂蜜及其他糖浆 20-40 食品的加工过程经常有一些涉及对水的加工处理,如采用一定的方式从食品中除去水分 (加热干燥、蒸发浓缩、超滤、反渗透等),或将水分转化为非活性成分(冷冻),或将水分 物理固定(凝胶),以达到提高食品稳定性的目的。因此研究水的结构和物理化学特性,食 品中水分的分布及其状态,对食品化学和食品保藏技术有重要意义。 1.1 水的结构和性质 1.1.1 水的结构(Structure) 水分子由两个氢原子的 s 轨道与一个氧原子的两个 sp3 杂化轨道形成两个 共价键(具

有 40%离子性质)。水分子为四面体结构,氧原子位于四面体中心,四面体的四个顶点中有 两个被氢原子占据,其余两个为氧原子的非共用电子对所占有(图 1-1)。气态水分子两个 O-H 键的夹角即 H-O-H 的键角为 104.5°,与典型四面体夹角 109°28′很接近,键角之所 以小了约 5°是由于受到氧原子的孤对电子排斥的影响,此外,O-H 核间距 0.096 nm,氢和 氧的范德瓦尔斯(van der Waals)半径分别为 0.12 nm 和 0.14nm。 图 1-1 单分子水的立体模式 由于自然界中 H、O 两种元素存在着同位素,所以纯水中除常见的 H2O 外,实际上还 存在其它的一些同位素的微量成分,但它们在自然界的水中所占比例极小。 常温下水是一种有结构的液体。在液态水中,若干个水分子缔合成为(H2O)n 的水分 子簇。这是由于水分子是偶极分子(在气态时为 1.84D),它们之间的作用是通过静电吸引 力(氢原子的♁端同氧原子的Θ端)及产生氢键(键能约为 2~40 kJ·mol-1)形成的。氧原子 的两个孤对电子与邻近的两个水分子的氢原子产生氢键,形成如图 1.2 所示的四面体结构。 每个水分子在三维空间的氢键给体数目和受体数目相等,因此,水分子间的吸引力比同样靠 氢键结合成分子簇的其它小分子(如 NH3 和 HF)要大得多。例如,氨分子是由三个氢给体 和一个氢受体构成的四面体;氟化氢的四面体只有一个氢给体和三个氢受体,它们只能在二 维空间形成氢键网络结构,因此比水分子包含的氢键数目要少。水分子形成三维氢键的能力 可以用于解释水分子的一些特殊物理化学性质,例如它的高熔点、高沸点、高比热和相变焓, 这些均与破坏水分子的氢键所需要的额外能量有关;水的高介电常数则是由于氢键所产生的 水分子簇,导致多分子偶极,从而有效地提高了水分子的介电常数。 图 1-2 水分子的四面体构型下的氢键模式(以虚线表示) 水分子的氢键键合程度与温度有关。在 0℃的冰中水分子的配位数为 4,随着温度的升 高,配位数增加,例如在 1.5℃和 83℃时,配位数分别为 4.4 和 4.9,配位数增加有增加水的 密度的效果;另外,由于温度升高,水分子布朗运动加剧,导致水分子间的距离增加,例如 1.5℃和 83℃时水分子之间的距离分别为 0.29 nm、0.305 nm,该变化导致体积膨胀,结果是 水的密度会降低。一般来说,温度在 0~4℃时,配位数的对水的密度影响起主导作用;随着 温度的进一步升高,布朗运动起主要作用,温度越高,水的密度越低。两种因素的最终结果 是水的密度在 3.98℃最大,低于、高于此温度则水的密度均会降低。 1.1.2 冰的结构
有 40%离子性质)。水分子为四面体结构,氧原子位于四面体中心,四面体的四个顶点中有 两个被氢原子占据,其余两个为氧原子的非共用电子对所占有(图 1-1)。气态水分子两个 O-H 键的夹角即 H-O-H 的键角为 104.5°,与典型四面体夹角 109°28′很接近,键角之所 以小了约 5°是由于受到氧原子的孤对电子排斥的影响,此外,O-H 核间距 0.096 nm,氢和 氧的范德瓦尔斯(van der Waals)半径分别为 0.12 nm 和 0.14nm。 图 1-1 单分子水的立体模式 由于自然界中 H、O 两种元素存在着同位素,所以纯水中除常见的 H2O 外,实际上还 存在其它的一些同位素的微量成分,但它们在自然界的水中所占比例极小。 常温下水是一种有结构的液体。在液态水中,若干个水分子缔合成为(H2O)n 的水分 子簇。这是由于水分子是偶极分子(在气态时为 1.84D),它们之间的作用是通过静电吸引 力(氢原子的♁端同氧原子的Θ端)及产生氢键(键能约为 2~40 kJ·mol-1)形成的。氧原子 的两个孤对电子与邻近的两个水分子的氢原子产生氢键,形成如图 1.2 所示的四面体结构。 每个水分子在三维空间的氢键给体数目和受体数目相等,因此,水分子间的吸引力比同样靠 氢键结合成分子簇的其它小分子(如 NH3 和 HF)要大得多。例如,氨分子是由三个氢给体 和一个氢受体构成的四面体;氟化氢的四面体只有一个氢给体和三个氢受体,它们只能在二 维空间形成氢键网络结构,因此比水分子包含的氢键数目要少。水分子形成三维氢键的能力 可以用于解释水分子的一些特殊物理化学性质,例如它的高熔点、高沸点、高比热和相变焓, 这些均与破坏水分子的氢键所需要的额外能量有关;水的高介电常数则是由于氢键所产生的 水分子簇,导致多分子偶极,从而有效地提高了水分子的介电常数。 图 1-2 水分子的四面体构型下的氢键模式(以虚线表示) 水分子的氢键键合程度与温度有关。在 0℃的冰中水分子的配位数为 4,随着温度的升 高,配位数增加,例如在 1.5℃和 83℃时,配位数分别为 4.4 和 4.9,配位数增加有增加水的 密度的效果;另外,由于温度升高,水分子布朗运动加剧,导致水分子间的距离增加,例如 1.5℃和 83℃时水分子之间的距离分别为 0.29 nm、0.305 nm,该变化导致体积膨胀,结果是 水的密度会降低。一般来说,温度在 0~4℃时,配位数的对水的密度影响起主导作用;随着 温度的进一步升高,布朗运动起主要作用,温度越高,水的密度越低。两种因素的最终结果 是水的密度在 3.98℃最大,低于、高于此温度则水的密度均会降低。 1.1.2 冰的结构

冰(ice)是由水分子构成的非常“疏松”的大而长的刚性结构,相比之下液态水则是 一种短而有序的结构,因此,冰的比容较大。冰在熔化时,一部分氢键断裂,所以转变成液 相后水分子紧密地靠拢在一起,密度增加。图 1-3 表示的是最普通的冰的晶胞示意图。 图 1-3 0℃ 时普通冰的晶胞 (圆圈表示水分子中的氧原子,最邻近水分子的 0-0 核间距是 0.276nm, =109°) 在普通冰晶体中,最邻近的水分子的 O-O 核间距为 0.276 nm,O-O-O 键角约为 109º, 接近理想四面体键 109 28'。每个水分子的配位数等于4,均与最邻近的四个水分子缔合可 形成四面体结构。 当几个晶胞结合在一起形成晶胞群时,从图 1-4 中可以清楚地看出冰的正六方结构。 从左图中可见,水分子 W 与水分子 1、2、3 和位于平面下的另外一个水分子(正好位于 W 的下面)形成四面体结构。如果从三维角度观察左图,则可以得到右图的结果,即冰结构中 存在两个平面(由空心和实心的圆分别表示),它们是接近和平行的,冰在压力下滑动或流 动时它们作为一个单元运动,类似于冰川的结构。此类平面构成冰的“基本平面”,许多平 面的堆积就构成了冰的结构,它的结构中水分子在空间的配置是完美的,冰在 C 轴方向是 单折射而在其它方向是双折射,所以 C 轴是冰的光学轴。 (1) (2) 图 1-4 冰的“基本平面”。每个圆代表一个水分子的氧原子,空心和实心代表基本平面上层和下层中氧原子 (1)从 C 轴所观察到的正六边形结构;(2)基本平面的三维图。 冰有 11 种结构,但是在常压和温度 0℃时,只有普通正六方晶系的冰晶体是稳定的。 另外还有 9 种同质多晶(Polymorphism) 和一种非结晶或玻璃态的无定形结构。在冷冻食 品中存在 4 种主要的冰晶体结构,即六方形、不规则树枝状、 粗糙的球形和易消失的球晶, 以及各种中间状态的冰晶体。大多数冷冻食品中的冰晶体是高度有序的六方形结构,但在含 有大量明胶的水溶液中,由于明胶对水分子运动的限制以及妨碍水分子形成高度有序的正六 方结晶,冰晶体主要是立方体和玻璃状冰晶。 在水的冰点温度时,水并不一定结冰,其原因包括溶质可以降低水的冰点,再就是产生 过冷现象。所谓过冷(supercooling)是由于无晶核存在,液体水温度降到冰点以下仍不析 出固体。但是,若向过冷水中投入一粒冰晶或摩擦器壁产生冰晶,过冷现象立即消失。当在 过冷溶液中加入晶核,则会在这些晶核的周围逐渐形成长大的结晶,这种现象称为异相成核 (Heterogeneous nucleation)。过冷度愈高,结晶速度愈慢,这对冰晶的大小是很重要的。当
冰(ice)是由水分子构成的非常“疏松”的大而长的刚性结构,相比之下液态水则是 一种短而有序的结构,因此,冰的比容较大。冰在熔化时,一部分氢键断裂,所以转变成液 相后水分子紧密地靠拢在一起,密度增加。图 1-3 表示的是最普通的冰的晶胞示意图。 图 1-3 0℃ 时普通冰的晶胞 (圆圈表示水分子中的氧原子,最邻近水分子的 0-0 核间距是 0.276nm, =109°) 在普通冰晶体中,最邻近的水分子的 O-O 核间距为 0.276 nm,O-O-O 键角约为 109º, 接近理想四面体键 109 28'。每个水分子的配位数等于4,均与最邻近的四个水分子缔合可 形成四面体结构。 当几个晶胞结合在一起形成晶胞群时,从图 1-4 中可以清楚地看出冰的正六方结构。 从左图中可见,水分子 W 与水分子 1、2、3 和位于平面下的另外一个水分子(正好位于 W 的下面)形成四面体结构。如果从三维角度观察左图,则可以得到右图的结果,即冰结构中 存在两个平面(由空心和实心的圆分别表示),它们是接近和平行的,冰在压力下滑动或流 动时它们作为一个单元运动,类似于冰川的结构。此类平面构成冰的“基本平面”,许多平 面的堆积就构成了冰的结构,它的结构中水分子在空间的配置是完美的,冰在 C 轴方向是 单折射而在其它方向是双折射,所以 C 轴是冰的光学轴。 (1) (2) 图 1-4 冰的“基本平面”。每个圆代表一个水分子的氧原子,空心和实心代表基本平面上层和下层中氧原子 (1)从 C 轴所观察到的正六边形结构;(2)基本平面的三维图。 冰有 11 种结构,但是在常压和温度 0℃时,只有普通正六方晶系的冰晶体是稳定的。 另外还有 9 种同质多晶(Polymorphism) 和一种非结晶或玻璃态的无定形结构。在冷冻食 品中存在 4 种主要的冰晶体结构,即六方形、不规则树枝状、 粗糙的球形和易消失的球晶, 以及各种中间状态的冰晶体。大多数冷冻食品中的冰晶体是高度有序的六方形结构,但在含 有大量明胶的水溶液中,由于明胶对水分子运动的限制以及妨碍水分子形成高度有序的正六 方结晶,冰晶体主要是立方体和玻璃状冰晶。 在水的冰点温度时,水并不一定结冰,其原因包括溶质可以降低水的冰点,再就是产生 过冷现象。所谓过冷(supercooling)是由于无晶核存在,液体水温度降到冰点以下仍不析 出固体。但是,若向过冷水中投入一粒冰晶或摩擦器壁产生冰晶,过冷现象立即消失。当在 过冷溶液中加入晶核,则会在这些晶核的周围逐渐形成长大的结晶,这种现象称为异相成核 (Heterogeneous nucleation)。过冷度愈高,结晶速度愈慢,这对冰晶的大小是很重要的。当

大量的水慢慢冷却时,由于有足够的时间在冰点温度产生异相成核,因而形成粗大的晶体结 构。若冷却速度很快就会发生很高的过冷现象,则很快形成晶核,但由于晶核增长速度相对 较慢,因而就会形成微细的结晶结构,这对于冷冻食品的品质提高是十分重要的。 冰晶体的大小和结晶速度受溶质、温度、降温速度等因素影响,溶质的种类和数量也影 响冰晶体的数量、大小、结构、位置和取向。图 1-5 为冷冻时晶核形成速率与晶体长大速率 的关系示意图。 图 1-5 晶核形成与晶体成长速率示意图 冰晶的大小与晶核数目有关,形成的晶核愈多则晶体愈小。结晶温度和结晶热传递速度 直接影响晶核数目的多少。若使体系温度维持在冰点和 A 点(图 1-5)之间将只能形成少量 的晶核,每个晶核可很快长大为的大冰晶;缓慢除去冷冻体系的热能,也同样可以得到相似 的结果,例如对食品或未搅动的液体体系,若缓慢地除去热能,则会慢慢形成连续的冰晶相; 如果很快除去热能使温度下降至 A 点,即可形成许多晶核,但每个晶体只能长大到一定的 程度,结果得到许多小结晶;搅拌则可以促进晶核的生成并使晶体变小。临界温度结冰时形 成小的结晶,所存在的其它物质不但能使冰点下降,而且还降低晶核形成的温度;低浓度蛋 白质、酒精和糖等均可阻滞晶体的成长过程。另外,一旦冰结晶形成并在冰点温度下贮存时 就会促使晶体长大。当贮存温度在很大范围内变化时,就很容易产生重结晶现象,结果是小 结晶数量减少并形成大结晶。食品组织缓慢冷冻,可以使大冰晶全部分布在细胞外部,而快 速冻结则可在细胞内外都形成小冰晶。 虽然有关冰晶的分布与冷冻食品质量的关系还不十分了解,但是食品在冷冻时,由于水 转变成冰时可产生“浓缩效应”,即食品体系中有一部分水转变为冰的时候,溶质的浓度相 应增加,同时 pH、离子强度、粘度、渗透压、蒸汽压及其它性质也会发生变化,从而会影 响食品的品质。 “浓缩效应”可以导致蛋白质絮凝、鱼肉质地变硬,化学反应速度增加等 不良变化,甚至一些酶在冷冻时被激活,从而对食品的品质产生影响,这些在具体食品加工 中需注意。 1.1.3 水的物理性质特点 (1)水的比热、汽化热、熔化热大 这是由于水分子间强烈的氢键缔合作用而导致产生的,当发生相转变时,必须供给额外 的能量来破坏水分子之间的氢键。这对食品冷冻、干燥和加工都是非常重要的因素。 (2)水的介电常数大、溶解力强 水的介电常数同样会受到氢键键合的影响,虽然水分子是一个偶极子,但水分子间靠氢 键键合形成分子群,成为多极子,这便导致水的介电常数增大。20℃时水的介电常数 80.36。 而大多数生物体内干物质的介电常数为 2.2~4.0。理论上,任何物质的水分含量增加 1%,介 电常数增加 0.8 左右。 由于水的介电常数大,因此水溶解离子型化合物的能力较强;至于非离子极性化合物如 糖类、醇类、醛类等均可与水形成氢键而溶于水中。即使不溶于水的物质,如脂肪和某些蛋 白质,也能在适当的条件下分散在水中形成乳浊液或胶体溶液
大量的水慢慢冷却时,由于有足够的时间在冰点温度产生异相成核,因而形成粗大的晶体结 构。若冷却速度很快就会发生很高的过冷现象,则很快形成晶核,但由于晶核增长速度相对 较慢,因而就会形成微细的结晶结构,这对于冷冻食品的品质提高是十分重要的。 冰晶体的大小和结晶速度受溶质、温度、降温速度等因素影响,溶质的种类和数量也影 响冰晶体的数量、大小、结构、位置和取向。图 1-5 为冷冻时晶核形成速率与晶体长大速率 的关系示意图。 图 1-5 晶核形成与晶体成长速率示意图 冰晶的大小与晶核数目有关,形成的晶核愈多则晶体愈小。结晶温度和结晶热传递速度 直接影响晶核数目的多少。若使体系温度维持在冰点和 A 点(图 1-5)之间将只能形成少量 的晶核,每个晶核可很快长大为的大冰晶;缓慢除去冷冻体系的热能,也同样可以得到相似 的结果,例如对食品或未搅动的液体体系,若缓慢地除去热能,则会慢慢形成连续的冰晶相; 如果很快除去热能使温度下降至 A 点,即可形成许多晶核,但每个晶体只能长大到一定的 程度,结果得到许多小结晶;搅拌则可以促进晶核的生成并使晶体变小。临界温度结冰时形 成小的结晶,所存在的其它物质不但能使冰点下降,而且还降低晶核形成的温度;低浓度蛋 白质、酒精和糖等均可阻滞晶体的成长过程。另外,一旦冰结晶形成并在冰点温度下贮存时 就会促使晶体长大。当贮存温度在很大范围内变化时,就很容易产生重结晶现象,结果是小 结晶数量减少并形成大结晶。食品组织缓慢冷冻,可以使大冰晶全部分布在细胞外部,而快 速冻结则可在细胞内外都形成小冰晶。 虽然有关冰晶的分布与冷冻食品质量的关系还不十分了解,但是食品在冷冻时,由于水 转变成冰时可产生“浓缩效应”,即食品体系中有一部分水转变为冰的时候,溶质的浓度相 应增加,同时 pH、离子强度、粘度、渗透压、蒸汽压及其它性质也会发生变化,从而会影 响食品的品质。 “浓缩效应”可以导致蛋白质絮凝、鱼肉质地变硬,化学反应速度增加等 不良变化,甚至一些酶在冷冻时被激活,从而对食品的品质产生影响,这些在具体食品加工 中需注意。 1.1.3 水的物理性质特点 (1)水的比热、汽化热、熔化热大 这是由于水分子间强烈的氢键缔合作用而导致产生的,当发生相转变时,必须供给额外 的能量来破坏水分子之间的氢键。这对食品冷冻、干燥和加工都是非常重要的因素。 (2)水的介电常数大、溶解力强 水的介电常数同样会受到氢键键合的影响,虽然水分子是一个偶极子,但水分子间靠氢 键键合形成分子群,成为多极子,这便导致水的介电常数增大。20℃时水的介电常数 80.36。 而大多数生物体内干物质的介电常数为 2.2~4.0。理论上,任何物质的水分含量增加 1%,介 电常数增加 0.8 左右。 由于水的介电常数大,因此水溶解离子型化合物的能力较强;至于非离子极性化合物如 糖类、醇类、醛类等均可与水形成氢键而溶于水中。即使不溶于水的物质,如脂肪和某些蛋 白质,也能在适当的条件下分散在水中形成乳浊液或胶体溶液

(3)水的密度 水的密度的变化和温度变化相关,另外冰的密度也与温度有关,冰结晶的成长及冰体积 的膨胀都会引起食品的细胞组织机械损伤和破坏,从而使冷冻食品质地发生物理变化。 1.2 水的等温吸着曲线(Moisture sorption isotherms) 1.2.1 水的存在状态 人类在很早就认识到食品的腐败变质同水之间有着紧密的联系。虽然早期的这种认识不 够全面,但脱水仍然成为人类保存食品的一种重要的方法,因为食品浓缩或干燥处理均是降 低食品中水分的含量,提高溶质的浓度。食品中溶质的存在,使得食品中的水分以不同的状 态存在。从水与食品中非水成分的作用情况来划分,水在食品中是以游离水(或称为体相水、 自由水)和结合水(或称为固定水)两种状态存在的,这两种状态水的区别就在于它们同亲 水性物质的缔合程度的大小,而缔合程度的大小则又与非水成分的性质、盐的组成、pH、 温度等因素有关。 结合水(Bound water)或固定水(Immobilized water)是指存在于溶质及其它非水组分 邻近的那一部分水,与同一体系的游离水相比,它们呈现出低的流动性和其它显著不同的性 质,这些水在-40℃ 不会结冰,不能作为溶剂,在质子核磁共振(NMR)试验中使氢的谱 线变宽。 在复杂体系中存在着不同结合程度的水。结合程度最强的水已成为非水物质的整体部 分,这部分水被看作为“化合水”或者称为“组成水”(Constitutional water),它在高水分 含量食品中只占很小比例,例如,它们存在于蛋白质的空隙区域内或者成为化学水合物的一 部分。结合强度稍强的结合水称为“单层水”(Monolayer water)或邻近水(Vicinal water), 它们占据着非水成分的大多数亲水基团的第一层位置,按这种方式与离子或离子基团相缔合 的水是结合最紧的一种邻近水。“多层水”(Multilayer water)占有第一层中剩下的位置以及 形成单层水以外的几个水层,虽然多层水的结合强度不如单层水,但是仍与非水组分靠得足 够近,以致于它的性质也大大不同于纯水的性质。因此,结合水是由化合水和吸附水(单层 水+多层水)组成的。应该注意的是,结合水不是完全静止不动的,它们同邻近水分子之间 的位置交换作用会随着水结合程度的增加而降低,但是它们之间的交换速度不会为零。 游离水(Free water)或体相水(Bulk water)就是指没有与非水成分结合的水。它又可 分为三类:不移动水或滞化水、毛细管水和自由流动水。滞化水(Entrapped water)是指被 组织中的显微和亚显微结构与膜所阻留住的水,由于这些水不能自由流动,所以称为不可移 动水或滞化水,例如一块重 100 g 的动物肌肉组织中,总含水量为 70~75g,含蛋白质 20 g, 除去近 10 g 结合水外,还有 60~65 g 的水,这部分水中极大部分是滞化水。毛细管水(Capillary water)是指在生物组织的细胞间隙、制成食品的结构组织中,存在着的一种由毛细管力所 截留的水,在生物组织中又称为细胞间水,其物理和化学性质与滞化水相同。而自由流动水 (Free flow water)是指动物的血浆、淋巴和尿液、植物的导管和细胞内液泡中的水,因为 都可以自由流动,所以叫自由流动水。 表 1-2 食品中水的分类与特征 分 类 特 征 典型食品中比例(%) 结合水 化合水 食品非水成分的组成部分 0.03% 单层水 与非水成分的亲水基团强烈作用形成单分 子层;水-离子以及水-偶极结合 0.1~0.9%
(3)水的密度 水的密度的变化和温度变化相关,另外冰的密度也与温度有关,冰结晶的成长及冰体积 的膨胀都会引起食品的细胞组织机械损伤和破坏,从而使冷冻食品质地发生物理变化。 1.2 水的等温吸着曲线(Moisture sorption isotherms) 1.2.1 水的存在状态 人类在很早就认识到食品的腐败变质同水之间有着紧密的联系。虽然早期的这种认识不 够全面,但脱水仍然成为人类保存食品的一种重要的方法,因为食品浓缩或干燥处理均是降 低食品中水分的含量,提高溶质的浓度。食品中溶质的存在,使得食品中的水分以不同的状 态存在。从水与食品中非水成分的作用情况来划分,水在食品中是以游离水(或称为体相水、 自由水)和结合水(或称为固定水)两种状态存在的,这两种状态水的区别就在于它们同亲 水性物质的缔合程度的大小,而缔合程度的大小则又与非水成分的性质、盐的组成、pH、 温度等因素有关。 结合水(Bound water)或固定水(Immobilized water)是指存在于溶质及其它非水组分 邻近的那一部分水,与同一体系的游离水相比,它们呈现出低的流动性和其它显著不同的性 质,这些水在-40℃ 不会结冰,不能作为溶剂,在质子核磁共振(NMR)试验中使氢的谱 线变宽。 在复杂体系中存在着不同结合程度的水。结合程度最强的水已成为非水物质的整体部 分,这部分水被看作为“化合水”或者称为“组成水”(Constitutional water),它在高水分 含量食品中只占很小比例,例如,它们存在于蛋白质的空隙区域内或者成为化学水合物的一 部分。结合强度稍强的结合水称为“单层水”(Monolayer water)或邻近水(Vicinal water), 它们占据着非水成分的大多数亲水基团的第一层位置,按这种方式与离子或离子基团相缔合 的水是结合最紧的一种邻近水。“多层水”(Multilayer water)占有第一层中剩下的位置以及 形成单层水以外的几个水层,虽然多层水的结合强度不如单层水,但是仍与非水组分靠得足 够近,以致于它的性质也大大不同于纯水的性质。因此,结合水是由化合水和吸附水(单层 水+多层水)组成的。应该注意的是,结合水不是完全静止不动的,它们同邻近水分子之间 的位置交换作用会随着水结合程度的增加而降低,但是它们之间的交换速度不会为零。 游离水(Free water)或体相水(Bulk water)就是指没有与非水成分结合的水。它又可 分为三类:不移动水或滞化水、毛细管水和自由流动水。滞化水(Entrapped water)是指被 组织中的显微和亚显微结构与膜所阻留住的水,由于这些水不能自由流动,所以称为不可移 动水或滞化水,例如一块重 100 g 的动物肌肉组织中,总含水量为 70~75g,含蛋白质 20 g, 除去近 10 g 结合水外,还有 60~65 g 的水,这部分水中极大部分是滞化水。毛细管水(Capillary water)是指在生物组织的细胞间隙、制成食品的结构组织中,存在着的一种由毛细管力所 截留的水,在生物组织中又称为细胞间水,其物理和化学性质与滞化水相同。而自由流动水 (Free flow water)是指动物的血浆、淋巴和尿液、植物的导管和细胞内液泡中的水,因为 都可以自由流动,所以叫自由流动水。 表 1-2 食品中水的分类与特征 分 类 特 征 典型食品中比例(%) 结合水 化合水 食品非水成分的组成部分 0.03% 单层水 与非水成分的亲水基团强烈作用形成单分 子层;水-离子以及水-偶极结合 0.1~0.9%

多层水 在亲水基团外形成另外的分子层;水-水以 及水-溶质结合 1~5% 游离水 自由流动水 自由流动,性质同稀的盐溶液,水-水结合 为主 5%到 96% 滞化水和毛细管水 容纳于凝胶或基质中,水不能流动,性质同 自由流动水 5%到 96% 食品中结合水和体相水之间的界限是很难定量地作截然的区分的,只能根据物理、化学 性质作定性的区别(见下表)。 表 1-3 食品中水的性质 性质 结合水 体相水 一般描述 存在于溶质或其他非水组分附近的水。 包括化合水、邻近水及几乎全部多层水 位置上远离非水组分,以 水-水氢键存在 冰点(与纯水比较) 冰点大为降低,甚至在-40℃不结冰 能结冰,冰点略微降低 溶剂能力 无 大 平均分子水平运动 大大降低甚至无 变化很小 蒸发焓(与纯水比) 增大 基本无变化 高水分食品中占总水分比例(%) <0.03~3 约 96% 微生物利用性 不能 能 1.2.2 水与溶质的相互作用 由于水在溶液中的存在状态,与溶质的性质以及溶质同水分子的相互作用有关,下面分 别介绍不同种类溶质与水之间的相互作用。 (1) 水与离子或离子基团的相互作用 离子或离子基团(Na+, Cl-, -COO-, -NH+3 等)通过自身的电荷可以与水分子偶极子产 生相互作用,通常称为水合作用。与离子和离子基团相互作用的水,是食品中结合最紧 密的一部分水。从实际情况来看,所有的离子对水的正常结构均有破坏作用,典型的特 征就是水中加入盐类以后,水的冰点下降。 当水中添加可离解的溶质时,纯水的正常结构遭到破坏。由于水分子具有大的偶极矩, 因此能与离子产生相互作用,如图 1-6,由于水分子同 Na+的水合作用能约 83.68 kJ·mol-1, 比水分子之间氢键结合(约 20.9 kJ·mol-1)大四倍,因此离子或离子基团加入到水中,会破 坏水中的氢键,导致改变水的流动性。 图 1-6 离子的水合作用和水分子的取向 在稀盐溶液中,离子对水结构的影响是不同的,一些离子(例如 K+、Rb+ 、Cs 、NH4 +、 Cl-、Br-、I -、NO3 -、BrO3 -、IO3 -和 ClO4 -等)由于离子半径大,电场强度弱,能破坏水的网 状结构,所以溶液比纯水的流动性更大。而对于电场强度较强、离子半径小的离子或多价离 子,它们有助于水形成网状结构,因此这类离子的水溶液比纯水的流动性小,例如 Li+、Na+、 H3O+、Ca2+、Ba2+、Mg2+、Al3+、F -和 OH-等就属于这一类。实际上,从水的正常结构来看
多层水 在亲水基团外形成另外的分子层;水-水以 及水-溶质结合 1~5% 游离水 自由流动水 自由流动,性质同稀的盐溶液,水-水结合 为主 5%到 96% 滞化水和毛细管水 容纳于凝胶或基质中,水不能流动,性质同 自由流动水 5%到 96% 食品中结合水和体相水之间的界限是很难定量地作截然的区分的,只能根据物理、化学 性质作定性的区别(见下表)。 表 1-3 食品中水的性质 性质 结合水 体相水 一般描述 存在于溶质或其他非水组分附近的水。 包括化合水、邻近水及几乎全部多层水 位置上远离非水组分,以 水-水氢键存在 冰点(与纯水比较) 冰点大为降低,甚至在-40℃不结冰 能结冰,冰点略微降低 溶剂能力 无 大 平均分子水平运动 大大降低甚至无 变化很小 蒸发焓(与纯水比) 增大 基本无变化 高水分食品中占总水分比例(%) <0.03~3 约 96% 微生物利用性 不能 能 1.2.2 水与溶质的相互作用 由于水在溶液中的存在状态,与溶质的性质以及溶质同水分子的相互作用有关,下面分 别介绍不同种类溶质与水之间的相互作用。 (1) 水与离子或离子基团的相互作用 离子或离子基团(Na+, Cl-, -COO-, -NH+3 等)通过自身的电荷可以与水分子偶极子产 生相互作用,通常称为水合作用。与离子和离子基团相互作用的水,是食品中结合最紧 密的一部分水。从实际情况来看,所有的离子对水的正常结构均有破坏作用,典型的特 征就是水中加入盐类以后,水的冰点下降。 当水中添加可离解的溶质时,纯水的正常结构遭到破坏。由于水分子具有大的偶极矩, 因此能与离子产生相互作用,如图 1-6,由于水分子同 Na+的水合作用能约 83.68 kJ·mol-1, 比水分子之间氢键结合(约 20.9 kJ·mol-1)大四倍,因此离子或离子基团加入到水中,会破 坏水中的氢键,导致改变水的流动性。 图 1-6 离子的水合作用和水分子的取向 在稀盐溶液中,离子对水结构的影响是不同的,一些离子(例如 K+、Rb+ 、Cs 、NH4 +、 Cl-、Br-、I -、NO3 -、BrO3 -、IO3 -和 ClO4 -等)由于离子半径大,电场强度弱,能破坏水的网 状结构,所以溶液比纯水的流动性更大。而对于电场强度较强、离子半径小的离子或多价离 子,它们有助于水形成网状结构,因此这类离子的水溶液比纯水的流动性小,例如 Li+、Na+、 H3O+、Ca2+、Ba2+、Mg2+、Al3+、F -和 OH-等就属于这一类。实际上,从水的正常结构来看

所有的离子对水的结构都起破坏作用,因为它们均能阻止水在 0℃下结冰。 (2)水与极性基团的相互作用 水和极性基团(如-OH,-SH,-NH2 等)间的相互作用力比水与离子间的相互作用弱,例 如在蛋白质周围,结合水至少有两种存在状态,一种是直接被蛋白质结合的水分子,形成单 层水;另一种是外层水分子(即多层水),结合能力较弱,蛋白质的结合水中大部分属于这 种水,但与游离水相比,它们的移动性变小。除了上述两种情况外,当蛋白质中的极性基团 与几个水分子作用形成“水桥” 结构时(图 1-7),这部分水也是结合水。 图 1-7 木瓜蛋白酶中的三分子水桥 各种有机分子的不同极性基团与水形成氢键的牢固程度有所不同。蛋白质多肽链中赖氨酸 和精氨酸侧链上的氨基,天冬氨酸和谷氨酸侧链上的羧基,肽链两端的羧基和氨基,以及果胶 物质中的未酯化的羧基,无论是在晶体还是在溶液时,都是呈离解或离子态的基团;这些基团 与水形成氢键,键能大,结合得牢固。蛋白质结构中的酰胺基、淀粉、果胶质、纤维素等分子 中的羟基与水也能形成氢键,但键能较小,牢固程度差一些。 通过氢键而被结合的水流动性极小。一般来说,凡能够产生氢键键合的溶质可以强化纯水 的结构,至少不会破坏这种结构。然而在某些情况下,一些溶质在形成氢键时,键合的部位以 及取向在几何构型上与正常水不同,因此,这些溶质通常对水的正常结构也会产生破坏作用, 像尿素这种小的氢键键合溶质就对水的正常结构有明显的破坏作用。大多数能够形成氢键键合 的溶质都会阻碍水结冰,但当体系中添加具有氢键键合能力的溶质时,每摩尔溶液中的氢键总 数不会明显地改变,这可能是由于所断裂的水-水氢键被水-溶质氢键所代替。 (3)水与非极性基团的相互作用 把疏水物质,如含有非极性基团(疏水基)的烃类、脂肪酸、氨基酸以及蛋白质加入水 中,由于极性的差异发生了体系的熵减少,在热力学上是不利的,此过程称为疏水水合 (Hydrophobic hydration),由于疏水基团与水分子产生斥力,从而使疏水基团附近的水分子 之间的氢键键合增强,使得疏水基邻近的水形成了特殊的结构,水分子在疏水基外围定向排 列,导致的熵减少。水对于非极性物质产生的作用中,其中有两个方面特别值得注意:笼形 水合物(Clathrate hydrates)的形成和蛋白质中的疏水相互作用。 笼形水合物代表水对疏水物质的最大结构形成响应。笼形水合物是冰状包合物,其中水 为“主体”物质,通过氢键形成了笼状结构,物理截留了另一种被称为“客体”的分子。笼 形水合物的客体分子是低分子量化合物,它的大小和形状与由 20~74 个水分子组成的主体笼 的大小相似,典型的客体包括低分子量的烃类及卤化烃、稀有气体、SO2、CO2、环氧乙烷、 乙醇、短链的伯胺、仲胺及叔胺、烷基铵等,水与客体之间相互作用往往涉及到弱的范德华 力,但有些情况下为静电相互作用。此外,分子量大的“客体”如蛋白质、糖类、脂类和生
所有的离子对水的结构都起破坏作用,因为它们均能阻止水在 0℃下结冰。 (2)水与极性基团的相互作用 水和极性基团(如-OH,-SH,-NH2 等)间的相互作用力比水与离子间的相互作用弱,例 如在蛋白质周围,结合水至少有两种存在状态,一种是直接被蛋白质结合的水分子,形成单 层水;另一种是外层水分子(即多层水),结合能力较弱,蛋白质的结合水中大部分属于这 种水,但与游离水相比,它们的移动性变小。除了上述两种情况外,当蛋白质中的极性基团 与几个水分子作用形成“水桥” 结构时(图 1-7),这部分水也是结合水。 图 1-7 木瓜蛋白酶中的三分子水桥 各种有机分子的不同极性基团与水形成氢键的牢固程度有所不同。蛋白质多肽链中赖氨酸 和精氨酸侧链上的氨基,天冬氨酸和谷氨酸侧链上的羧基,肽链两端的羧基和氨基,以及果胶 物质中的未酯化的羧基,无论是在晶体还是在溶液时,都是呈离解或离子态的基团;这些基团 与水形成氢键,键能大,结合得牢固。蛋白质结构中的酰胺基、淀粉、果胶质、纤维素等分子 中的羟基与水也能形成氢键,但键能较小,牢固程度差一些。 通过氢键而被结合的水流动性极小。一般来说,凡能够产生氢键键合的溶质可以强化纯水 的结构,至少不会破坏这种结构。然而在某些情况下,一些溶质在形成氢键时,键合的部位以 及取向在几何构型上与正常水不同,因此,这些溶质通常对水的正常结构也会产生破坏作用, 像尿素这种小的氢键键合溶质就对水的正常结构有明显的破坏作用。大多数能够形成氢键键合 的溶质都会阻碍水结冰,但当体系中添加具有氢键键合能力的溶质时,每摩尔溶液中的氢键总 数不会明显地改变,这可能是由于所断裂的水-水氢键被水-溶质氢键所代替。 (3)水与非极性基团的相互作用 把疏水物质,如含有非极性基团(疏水基)的烃类、脂肪酸、氨基酸以及蛋白质加入水 中,由于极性的差异发生了体系的熵减少,在热力学上是不利的,此过程称为疏水水合 (Hydrophobic hydration),由于疏水基团与水分子产生斥力,从而使疏水基团附近的水分子 之间的氢键键合增强,使得疏水基邻近的水形成了特殊的结构,水分子在疏水基外围定向排 列,导致的熵减少。水对于非极性物质产生的作用中,其中有两个方面特别值得注意:笼形 水合物(Clathrate hydrates)的形成和蛋白质中的疏水相互作用。 笼形水合物代表水对疏水物质的最大结构形成响应。笼形水合物是冰状包合物,其中水 为“主体”物质,通过氢键形成了笼状结构,物理截留了另一种被称为“客体”的分子。笼 形水合物的客体分子是低分子量化合物,它的大小和形状与由 20~74 个水分子组成的主体笼 的大小相似,典型的客体包括低分子量的烃类及卤化烃、稀有气体、SO2、CO2、环氧乙烷、 乙醇、短链的伯胺、仲胺及叔胺、烷基铵等,水与客体之间相互作用往往涉及到弱的范德华 力,但有些情况下为静电相互作用。此外,分子量大的“客体”如蛋白质、糖类、脂类和生

物细胞内的其他物质也能与水形成笼形水合物,使水合物的凝固点降低。一些笼形水合物具 有较高的稳定性。 笼形水合物的微结晶与冰的晶体很相似,但当形成大的晶体时,原来的四面体结构逐渐 变成多面体结构,在外表上与冰的结构存在很大差异。笼形水合物晶体在 0℃以上和适当压 力下仍能保持稳定的晶体结构。已证明生物物质中天然存在类似晶体的笼形水合物结构,它 们很可能对蛋白质等生物大分子的构象、反应性和稳定性有影响。笼形水合物晶体目前尚未 商业化开发利用,在海洋资源开发中,可燃冰(甲烷的水合物)的前景被看好。 疏水基相互作用(Hydrophobic interaction),是指疏水基尽可能聚集在一起以减少它们 与水的接触(图 1-8(3))。疏水基相互作用可以导致非极性物质分子的熵(分子混乱程度) 减小,因而产生热力学上不稳定的状态;由于分散在水中的疏水性物质相互集聚,导致使它 们与水的接触面积减小,结果引起蛋白质分子聚集,甚至沉淀;此外,疏水相互作用还包括 蛋白质与脂类的疏水结合。疏水性物质间的疏水基相互作用导致体系中自由水分子增多,所 以疏水基作用和极性物质、离子的水合作用一样,其溶质周围的水分子都同样伴随着熵减小, 然而,水分子之间的氢键键合在热力学上是一种稳定状态,从这一点上讲,疏水相互作用和 极性物质的水合作用有着本质上的区别。疏水相互作用对于维持蛋白质分子的结构发挥重要 的作用。 疏水基、疏水性物质在水中的作用情况见图 1-8。 (1) (2) (3) 图 1-8 疏水水合(1)与疏水相互作用(2)以及球蛋白的疏水相互作用(3) 1.2.3 水分活度(Water activity) 食品中水分的含量与食品的腐败变质存在着一定的关系,浓缩或脱水就是通过降低水分 含量,提高溶质的含量来提高食品的保存性。从上面的介绍中可以看出,由于在含水食品中 溶质对水的束缚能力会影响水的汽化、冻结、酶反应和微生物的利用等,考虑到这一点,仅 仅将水分含量作为食品中各种生物、化学反应对水的可利用性指标不是十分恰当的,例如我 们已经知道在相同的水分含量时,不同的食品的腐败难易程度是不同的;二是水与食品中非 水成分作用后处于不同的存在状态,与非水成分结合牢固的水被微生物或化学反应利用程度 降低。因此,目前一般采用水分活度(aw)表示水与食品成分之间的结合程度。在较低的温 度下,利用食品的水分活度比利用水分含量更容易确定食品的稳定性,所以目前它是食品质 量指标中更有实际意义的重要指标。食品中水分活度的表示为:
物细胞内的其他物质也能与水形成笼形水合物,使水合物的凝固点降低。一些笼形水合物具 有较高的稳定性。 笼形水合物的微结晶与冰的晶体很相似,但当形成大的晶体时,原来的四面体结构逐渐 变成多面体结构,在外表上与冰的结构存在很大差异。笼形水合物晶体在 0℃以上和适当压 力下仍能保持稳定的晶体结构。已证明生物物质中天然存在类似晶体的笼形水合物结构,它 们很可能对蛋白质等生物大分子的构象、反应性和稳定性有影响。笼形水合物晶体目前尚未 商业化开发利用,在海洋资源开发中,可燃冰(甲烷的水合物)的前景被看好。 疏水基相互作用(Hydrophobic interaction),是指疏水基尽可能聚集在一起以减少它们 与水的接触(图 1-8(3))。疏水基相互作用可以导致非极性物质分子的熵(分子混乱程度) 减小,因而产生热力学上不稳定的状态;由于分散在水中的疏水性物质相互集聚,导致使它 们与水的接触面积减小,结果引起蛋白质分子聚集,甚至沉淀;此外,疏水相互作用还包括 蛋白质与脂类的疏水结合。疏水性物质间的疏水基相互作用导致体系中自由水分子增多,所 以疏水基作用和极性物质、离子的水合作用一样,其溶质周围的水分子都同样伴随着熵减小, 然而,水分子之间的氢键键合在热力学上是一种稳定状态,从这一点上讲,疏水相互作用和 极性物质的水合作用有着本质上的区别。疏水相互作用对于维持蛋白质分子的结构发挥重要 的作用。 疏水基、疏水性物质在水中的作用情况见图 1-8。 (1) (2) (3) 图 1-8 疏水水合(1)与疏水相互作用(2)以及球蛋白的疏水相互作用(3) 1.2.3 水分活度(Water activity) 食品中水分的含量与食品的腐败变质存在着一定的关系,浓缩或脱水就是通过降低水分 含量,提高溶质的含量来提高食品的保存性。从上面的介绍中可以看出,由于在含水食品中 溶质对水的束缚能力会影响水的汽化、冻结、酶反应和微生物的利用等,考虑到这一点,仅 仅将水分含量作为食品中各种生物、化学反应对水的可利用性指标不是十分恰当的,例如我 们已经知道在相同的水分含量时,不同的食品的腐败难易程度是不同的;二是水与食品中非 水成分作用后处于不同的存在状态,与非水成分结合牢固的水被微生物或化学反应利用程度 降低。因此,目前一般采用水分活度(aw)表示水与食品成分之间的结合程度。在较低的温 度下,利用食品的水分活度比利用水分含量更容易确定食品的稳定性,所以目前它是食品质 量指标中更有实际意义的重要指标。食品中水分活度的表示为:
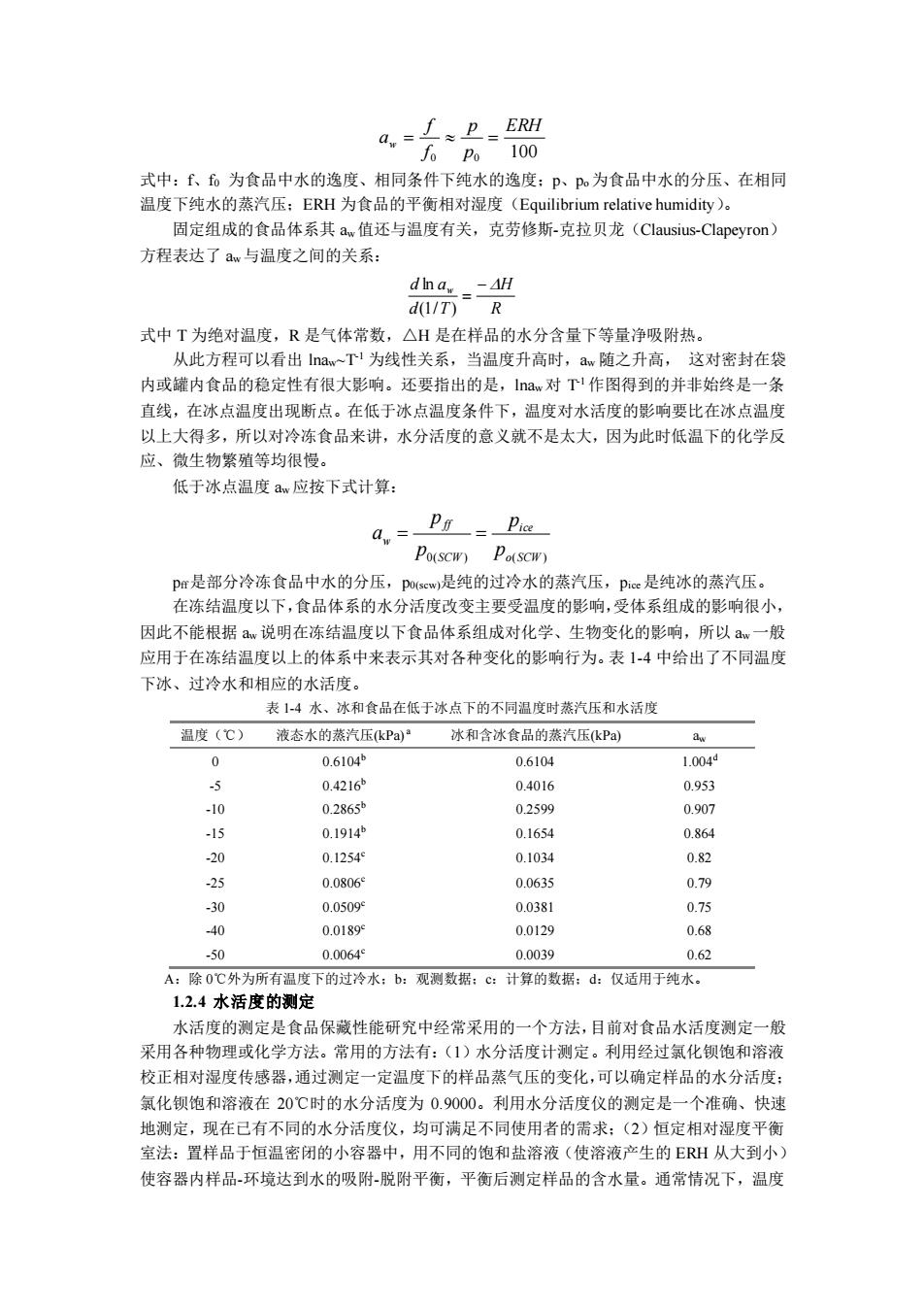
0 0 100 ERH p p f f aw = = 式中:f、f0 为食品中水的逸度、相同条件下纯水的逸度;p、po 为食品中水的分压、在相同 温度下纯水的蒸汽压;ERH 为食品的平衡相对湿度(Equilibrium relative humidity)。 固定组成的食品体系其 aw 值还与温度有关,克劳修斯-克拉贝龙(Clausius-Clapeyron) 方程表达了 aw 与温度之间的关系: R H d T d aw − = (1/ ) ln 式中 T 为绝对温度,R 是气体常数,△H 是在样品的水分含量下等量净吸附热。 从此方程可以看出 lnaw~T-1 为线性关系,当温度升高时,aw 随之升高, 这对密封在袋 内或罐内食品的稳定性有很大影响。还要指出的是,lnaw 对 T -1 作图得到的并非始终是一条 直线,在冰点温度出现断点。在低于冰点温度条件下,温度对水活度的影响要比在冰点温度 以上大得多,所以对冷冻食品来讲,水分活度的意义就不是太大,因为此时低温下的化学反 应、微生物繁殖等均很慢。 低于冰点温度 aw 应按下式计算: 0( ) o(SCW ) ice SCW ff w p p p p a = = pff是部分冷冻食品中水的分压,p0(scw)是纯的过冷水的蒸汽压,pice是纯冰的蒸汽压。 在冻结温度以下,食品体系的水分活度改变主要受温度的影响,受体系组成的影响很小, 因此不能根据 aw 说明在冻结温度以下食品体系组成对化学、生物变化的影响,所以 aw 一般 应用于在冻结温度以上的体系中来表示其对各种变化的影响行为。表 1-4 中给出了不同温度 下冰、过冷水和相应的水活度。 表 1-4 水、冰和食品在低于冰点下的不同温度时蒸汽压和水活度 温度(℃) 液态水的蒸汽压(kPa) a 冰和含冰食品的蒸汽压(kPa) aw 0 0.6104b 0.6104 1.004d -5 0.4216b 0.4016 0.953 -10 0.2865b 0.2599 0.907 -15 0.1914b 0.1654 0.864 -20 0.1254c 0.1034 0.82 -25 0.0806c 0.0635 0.79 -30 0.0509c 0.0381 0.75 -40 0.0189c 0.0129 0.68 -50 0.0064c 0.0039 0.62 A:除 0℃外为所有温度下的过冷水;b:观测数据;c:计算的数据;d:仅适用于纯水。 1.2.4 水活度的测定 水活度的测定是食品保藏性能研究中经常采用的一个方法,目前对食品水活度测定一般 采用各种物理或化学方法。常用的方法有:(1)水分活度计测定。利用经过氯化钡饱和溶液 校正相对湿度传感器,通过测定一定温度下的样品蒸气压的变化,可以确定样品的水分活度; 氯化钡饱和溶液在 20℃时的水分活度为 0.9000。利用水分活度仪的测定是一个准确、快速 地测定,现在已有不同的水分活度仪,均可满足不同使用者的需求;(2)恒定相对湿度平衡 室法:置样品于恒温密闭的小容器中,用不同的饱和盐溶液(使溶液产生的 ERH 从大到小) 使容器内样品-环境达到水的吸附-脱附平衡,平衡后测定样品的含水量。通常情况下,温度
0 0 100 ERH p p f f aw = = 式中:f、f0 为食品中水的逸度、相同条件下纯水的逸度;p、po 为食品中水的分压、在相同 温度下纯水的蒸汽压;ERH 为食品的平衡相对湿度(Equilibrium relative humidity)。 固定组成的食品体系其 aw 值还与温度有关,克劳修斯-克拉贝龙(Clausius-Clapeyron) 方程表达了 aw 与温度之间的关系: R H d T d aw − = (1/ ) ln 式中 T 为绝对温度,R 是气体常数,△H 是在样品的水分含量下等量净吸附热。 从此方程可以看出 lnaw~T-1 为线性关系,当温度升高时,aw 随之升高, 这对密封在袋 内或罐内食品的稳定性有很大影响。还要指出的是,lnaw 对 T -1 作图得到的并非始终是一条 直线,在冰点温度出现断点。在低于冰点温度条件下,温度对水活度的影响要比在冰点温度 以上大得多,所以对冷冻食品来讲,水分活度的意义就不是太大,因为此时低温下的化学反 应、微生物繁殖等均很慢。 低于冰点温度 aw 应按下式计算: 0( ) o(SCW ) ice SCW ff w p p p p a = = pff是部分冷冻食品中水的分压,p0(scw)是纯的过冷水的蒸汽压,pice是纯冰的蒸汽压。 在冻结温度以下,食品体系的水分活度改变主要受温度的影响,受体系组成的影响很小, 因此不能根据 aw 说明在冻结温度以下食品体系组成对化学、生物变化的影响,所以 aw 一般 应用于在冻结温度以上的体系中来表示其对各种变化的影响行为。表 1-4 中给出了不同温度 下冰、过冷水和相应的水活度。 表 1-4 水、冰和食品在低于冰点下的不同温度时蒸汽压和水活度 温度(℃) 液态水的蒸汽压(kPa) a 冰和含冰食品的蒸汽压(kPa) aw 0 0.6104b 0.6104 1.004d -5 0.4216b 0.4016 0.953 -10 0.2865b 0.2599 0.907 -15 0.1914b 0.1654 0.864 -20 0.1254c 0.1034 0.82 -25 0.0806c 0.0635 0.79 -30 0.0509c 0.0381 0.75 -40 0.0189c 0.0129 0.68 -50 0.0064c 0.0039 0.62 A:除 0℃外为所有温度下的过冷水;b:观测数据;c:计算的数据;d:仅适用于纯水。 1.2.4 水活度的测定 水活度的测定是食品保藏性能研究中经常采用的一个方法,目前对食品水活度测定一般 采用各种物理或化学方法。常用的方法有:(1)水分活度计测定。利用经过氯化钡饱和溶液 校正相对湿度传感器,通过测定一定温度下的样品蒸气压的变化,可以确定样品的水分活度; 氯化钡饱和溶液在 20℃时的水分活度为 0.9000。利用水分活度仪的测定是一个准确、快速 地测定,现在已有不同的水分活度仪,均可满足不同使用者的需求;(2)恒定相对湿度平衡 室法:置样品于恒温密闭的小容器中,用不同的饱和盐溶液(使溶液产生的 ERH 从大到小) 使容器内样品-环境达到水的吸附-脱附平衡,平衡后测定样品的含水量。通常情况下,温度

是恒定在 25℃,扩散时间依据样品性质变化较大,样品量约在 1g;通过在密闭条件下样品 与系列水分活度不同的标准饱和盐溶液之间的扩散-吸附平衡,测定、比较样品重量的变化 来计算样品的水分活度(推测值样品重量变化为零时的 aw);测定时要求有较长的时间,使 样品与饱和盐溶液之间达到扩散平衡才可以得到较好的准确数值。在没有水分活度仪的情况 下,这是一个很好的替代方法,不足之处是分析繁琐,时间较长。至于不同盐类饱和溶液的 aw 可以在理化手册上查找,也可以参考下面所给出的部分常用饱和盐溶液;(3)化学法。 利用化学法直接测定样品的水分活度时,利用与水不相溶的有机溶剂(一般采用高纯度的苯) 萃取样品中的水分,此时在苯中水的萃取量与样品的水活度成正比;通过卡尔-费休滴定法 测定样品萃取液中水含量,再通过与纯水萃取液滴定结果比较后,可以计算出样品中水分活 度。 表 1-5 一些饱和盐溶液所产生的恒定湿度 盐类 温度(℃) 湿度(%) 盐类 温度(℃) 湿度(%) 硝酸铅 20 98 溴化钠 20 58 磷酸二氢铵 20-25 93 重铬酸钠 20 52 铬酸钾 20 88 硫氰酸钾 20 47 硫酸铵 20 81 氯化钙 24.5 31 醋酸钠 20 76 醋酸钾 20 20 亚硝酸钠 20 66 氯化锂 20 15 1.2.5 水的吸湿等温线 要想了解食品中水的存在状态和对食品品质等的影响行为,必须知道各种食品的含水量 与其对应 aw 的关系。在一定温度条件下用来联系食品的含水量(用每单位干物质中的水含 量表示)与其水活度的图,称为吸湿等温线(Moisture sorption isotherms, MSI)。从这类图 形所得到的资料对于浓缩脱水过程是很有用的,因为水从体系中消除的难易程度与水活性有 关,在评价食品的稳定性时,确定用水分含量来抑制微生物的生长时,也必须知道水活度与 水分含量之间的关系。因此了解食品中水分含量与水活度之间的关系是十分有价值的。 图 1-9 是高含水量食品吸着等温线的示意图,它包括了从正常至干燥状态的整个水分含 量范围。这类示意图并不是很有用,因为对食品来讲有意义的数据是在低水分区域。图 1-10 为低水分含量食品的吸湿等温线的一个典型例子。一般来讲,不同的食品由于其组成不同, 其吸湿等温线的形状是不同的,并且曲线的形状还与样品的物理结构、样品的预处理、温度、 测定方法等因素有关。为了便于理解吸湿等温线的含义和实际应用,我们可以人为地将图 1-10 中表示的曲线范围分为三个不同的区间;当干燥的无水样品产生回吸作用而重新结合 水时,其水分含量、水活度等就从区间Ⅰ(干燥)向区间Ⅲ(高水分)移动,水吸着过程中 水存在状态、性质大不相同,有一定的差别。以下分别叙述各区间水的主要特性
是恒定在 25℃,扩散时间依据样品性质变化较大,样品量约在 1g;通过在密闭条件下样品 与系列水分活度不同的标准饱和盐溶液之间的扩散-吸附平衡,测定、比较样品重量的变化 来计算样品的水分活度(推测值样品重量变化为零时的 aw);测定时要求有较长的时间,使 样品与饱和盐溶液之间达到扩散平衡才可以得到较好的准确数值。在没有水分活度仪的情况 下,这是一个很好的替代方法,不足之处是分析繁琐,时间较长。至于不同盐类饱和溶液的 aw 可以在理化手册上查找,也可以参考下面所给出的部分常用饱和盐溶液;(3)化学法。 利用化学法直接测定样品的水分活度时,利用与水不相溶的有机溶剂(一般采用高纯度的苯) 萃取样品中的水分,此时在苯中水的萃取量与样品的水活度成正比;通过卡尔-费休滴定法 测定样品萃取液中水含量,再通过与纯水萃取液滴定结果比较后,可以计算出样品中水分活 度。 表 1-5 一些饱和盐溶液所产生的恒定湿度 盐类 温度(℃) 湿度(%) 盐类 温度(℃) 湿度(%) 硝酸铅 20 98 溴化钠 20 58 磷酸二氢铵 20-25 93 重铬酸钠 20 52 铬酸钾 20 88 硫氰酸钾 20 47 硫酸铵 20 81 氯化钙 24.5 31 醋酸钠 20 76 醋酸钾 20 20 亚硝酸钠 20 66 氯化锂 20 15 1.2.5 水的吸湿等温线 要想了解食品中水的存在状态和对食品品质等的影响行为,必须知道各种食品的含水量 与其对应 aw 的关系。在一定温度条件下用来联系食品的含水量(用每单位干物质中的水含 量表示)与其水活度的图,称为吸湿等温线(Moisture sorption isotherms, MSI)。从这类图 形所得到的资料对于浓缩脱水过程是很有用的,因为水从体系中消除的难易程度与水活性有 关,在评价食品的稳定性时,确定用水分含量来抑制微生物的生长时,也必须知道水活度与 水分含量之间的关系。因此了解食品中水分含量与水活度之间的关系是十分有价值的。 图 1-9 是高含水量食品吸着等温线的示意图,它包括了从正常至干燥状态的整个水分含 量范围。这类示意图并不是很有用,因为对食品来讲有意义的数据是在低水分区域。图 1-10 为低水分含量食品的吸湿等温线的一个典型例子。一般来讲,不同的食品由于其组成不同, 其吸湿等温线的形状是不同的,并且曲线的形状还与样品的物理结构、样品的预处理、温度、 测定方法等因素有关。为了便于理解吸湿等温线的含义和实际应用,我们可以人为地将图 1-10 中表示的曲线范围分为三个不同的区间;当干燥的无水样品产生回吸作用而重新结合 水时,其水分含量、水活度等就从区间Ⅰ(干燥)向区间Ⅲ(高水分)移动,水吸着过程中 水存在状态、性质大不相同,有一定的差别。以下分别叙述各区间水的主要特性