
第九章 菊物溶液的形成理论
第九章 药物溶液的形成理论

第一节药用溶剂的种类与性质 一、 药用溶剂的种类 ■(一)水溶剂 (二)非水溶剂
第一节 药用溶剂的种类与性质 一、药用溶剂的种类 ◼ (一)水溶剂 ◼ (二)非水溶剂

(一)水溶剂 水是最常用的极性溶剂。其理化性质稳 定,能与身体组织在生理上相适应,吸 收快,因此水溶性药物多制备成水溶液
(一)水溶剂 ◼ 水是最常用的极性溶剂。其理化性质稳 定,能与身体组织在生理上相适应,吸 收快,因此水溶性药物多制备成水溶液

(二)非水溶剂 1.醇类 这类溶剂多数能与水混合。 ■2.二氧戊环类 如甲醛缩甘油、 ■3.醚类 如四氢糠醛聚乙二醇醚 ■4.酰胺类 如二甲基甲酰胺、二甲基乙酰胺 ■5.酯类 如三醋酸甘油酯、苯甲酸苄酯 ■6.植物油类 如豆油、玉米油、芝麻油、花生油、 红花油等,作为油性制剂与乳剂的油相。 ■7.亚砜类 如二甲基亚砜,能与水、乙醇混溶
(二)非水溶剂 ◼ 1.醇类 这类溶剂多数能与水混合。 ◼ 2.二氧戊环类 如甲醛缩甘油、 ◼ 3.醚类 如四氢糠醛聚乙二醇醚 ◼ 4.酰胺类 如二甲基甲酰胺、二甲基乙酰胺 ◼ 5.酯类 如三醋酸甘油酯、苯甲酸苄酯 ◼ 6.植物油类 如豆油、玉米油、芝麻油、花生油、 红花油等,作为油性制剂与乳剂的油相。 ◼ 7.亚砜类 如二甲基亚砜,能与水、乙醇混溶

二、药用溶剂的性质 (一)介电常数(dielectric constant) (二) )溶解度参数(solubility parameter)
二、药用溶剂的性质 (一) 介电常数(dielectric constant) (二) 溶解度参数(solubility parameter)

(一)介电常数(dielectric constant) 溶剂的介电常数表示在溶液中将相反电荷分开的能力, 它反映溶剂分子的极性大小。 C Co ■式中,C。一在电容器中以空气为介质时的电容值, 通常测得空气的介电常数接近于1。 介电常数大的溶剂的极性大,介电常数小的极性小
(一)介电常数(dielectric constant) ◼ 溶剂的介电常数表示在溶液中将相反电荷分开的能力, 它反映溶剂分子的极性大小。 ◼ 式中,C0——在电容器中以空气为介质时的电容值, 通常测得空气的介电常数接近于1。 ◼ 介电常数大的溶剂的极性大,介电常数小的极性小
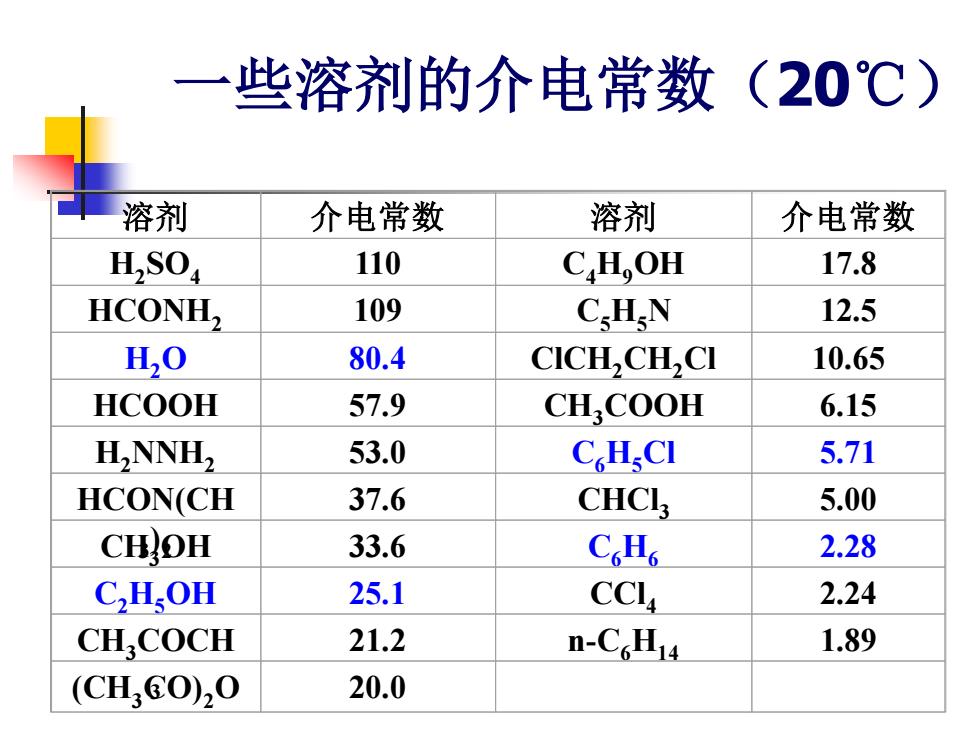
一些溶剂的介电常数(20℃) 溶剂 介电常数 溶剂 介电常数 H2S04 110 CH,OH 17.8 HCONH2 109 C.HN 12.5 H,0 80.4 CICH,CH,CI 10.65 HCOOH 57.9 CH.COOH 6.15 H,NNH, 53.0 C.HsCI 5.71 HCON(CH 37.6 CHCl3 5.00 CHOH 33.6 CoH6 2.28 C,H.OH 25.1 CCL 2.24 CH,COCH 21.2 n-CcH14 1.89 (CH60),0 20.0
一些溶剂的介电常数(20℃) 溶剂 介电常数 溶剂 介电常数 H2 SO4 110 C4H9OH 17.8 HCONH2 109 C5H5N 12.5 H2O 80.4 ClCH2CH2Cl 10.65 HCOOH 57.9 CH3COOH 6.15 H2NNH2 53.0 C6H5Cl 5.71 HCON(CH 3 ) 2 37.6 CHCl3 5.00 CH3OH 33.6 C6H6 2.28 C2H5OH 25.1 CCl4 2.24 CH3COCH 3 21.2 n-C6H14 1.89 (CH3CO)2O 20.0

溶质的溶解能力主要与溶质与溶剂间的 相互作用力有关。 ■ 溶质与溶剂间的相互作用力主要表现在 溶质与溶剂的极性、介电常数、溶剂化 作用、缔合、形成氢键等,其中溶剂的 介电常数大小顺序可预测某些物质的溶 解性能
◼ 溶质的溶解能力主要与溶质与溶剂间的 相互作用力有关。 ◼ 溶质与溶剂间的相互作用力主要表现在 溶质与溶剂的极性、介电常数、溶剂化 作用、缔合、形成氢键等,其中溶剂的 介电常数大小顺序可预测某些物质的溶 解性能

(二)溶解度参数(solubility parameter) 溶解度参数表示同种分子间的内聚能,也是表示分子 极性大小的一种量度。 ■溶解度参数越大,极性越大。 ■溶剂或溶质的溶解度参数δ可用式(8-2)表示。 式中,一= ;V—物质在液态时 的摩尔体积
(二)溶解度参数(solubility parameter) ◼ 溶解度参数表示同种分子间的内聚能,也是表示分子 极性大小的一种量度。 ◼ 溶解度参数越大,极性越大。 ◼ 溶剂或溶质的溶解度参数δi可用式(8-2)表示。 ◼ 式中,ΔUi——分子间的内聚能;Vi——物质在液态时 的摩尔体积
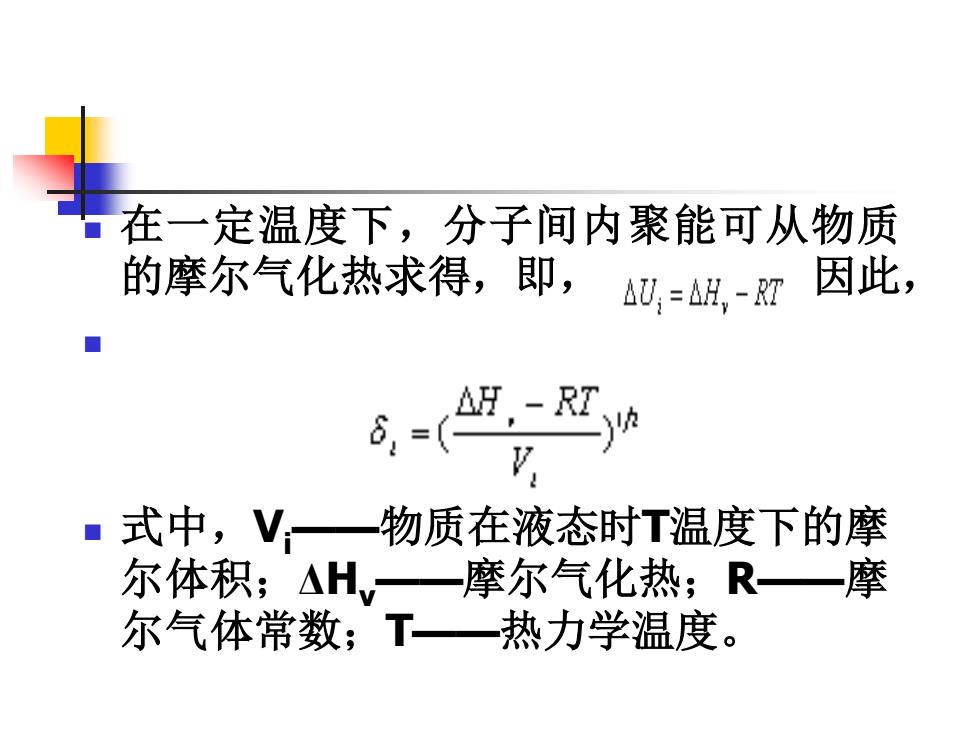
在一定温度下,分子间内聚能可从物质 的摩尔气化热求得,即,△=以-双因此 ■ ■式中,V,一物质在液态时T温度下的摩 尔体积;△H,一摩尔气化热;R一摩 尔气体常数;T一热力学温度
◼ 在一定温度下,分子间内聚能可从物质 的摩尔气化热求得,即, 因此, ◼ ◼ 式中,Vi——物质在液态时T温度下的摩 尔体积;ΔHv——摩尔气化热;R——摩 尔气体常数;T——热力学温度