
回H厄✉ Chapter6统计热力学的应用 平衡常数的计算 同核双原子分子的摩尔热容
Chapter 6 统计热力学的应用 平衡常数的计算 同核双原子分子的摩尔热容

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis mnovative Material §6-1.2理想气体配分函数的应用 平衡常数的计算 1.理想气体纯物质的自由能与化学势 G-4+PV--Nk,T'h Q+Nk,T--Nk,T'ln u= u=-kgT In =-RTIn N N 2.理想混合气体的自由能与化学势 混合气体的能量等于各类不同气体能量的加和: E=∑E 李振华制 2013/10/14 统计热力学第六章
李 振 华 制 2013/10/14 统计热力学第六章 2 造 §6-1.2 理想气体配分函数的应用 ——平衡常数的计算 1. 理想气体纯物质的自由能与化学势 N Q Q Nk T Nk T N e G A P V NkB T B B ln ln 2. 理想混合气体的自由能与化学势 混合气体的能量等于各类不同气体能量的加和: i E Ei N G N Q kB T ln N Q RT ln ~

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis Innovative Material 这一种类的分子也不能跳到另一种类的分子的能级上: ALNI A2,N2 A3,N3 A 所以各类分子的统计可以独立进行,好像其它分子不 存在似的。混合体系的性质如S,P,G,A等都可以看 作各个独立体系的加和。 李振华制 2013/10/14 统计热力学第六章 3
李 振 华 制 2013/10/14 统计热力学第六章 3 造 所以各类分子的统计可以独立进行,好像其它分子不 存在似的。混合体系的性质如S,P,G,A等都可以看 作各个独立体系的加和。 这一种类的分子也不能跳到另一种类的分子的能级上: A1 A2 A1 ,N1 A2 ,N2 A3 ,N3

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis mnovative Material 混合体系的自由能: 6-c,=-v,7h是 因为配分函数里只有平动配分函数和粒子数N有关: (2nmkgT)V (2mmkT)NkgT h hP 所以QW与N,没有关系。根据混合体系的化学势的定义: aG =-kgTIn ON:)T.P.N N 李振华 2013/10/14 统计热力学第六章 造
李 振 华 制 2013/10/14 统计热力学第六章 4 造 混合体系的自由能: i i i i B i i N Q G G N k T ln 因为配分函数里只有平动配分函数和粒子数N有关: h P mkT Nk T h mk T V Q B B t 3 3/ 2 3 3/ 2 (2 ) (2 ) 所以Qi /Ni与Ni没有关系。根据混合体系的化学势的定义: i i B i T P N i N Q k T N G j ln , ,

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis mvative Material 如果把配分函数写为Q,Qm' Q是内部运动的配分函数 (不过核配分函数在大部分情况下可以约掉): Cin=2.0.0.0 (2mkT)Nk,TO(2mkT)Nk,TO N N hPN hN P P 令: (2元kBT)3/2N4kBT_(2元mkBT)3/2V° h3po h 则: 2 O P 标准配分函数 NN P 2=Crnen() 2013/10/14 李振华制造 5
李 振 华 制 2013/10/14 统计热力学第六章 5 造 如果把配分函数写为QtQin,Qin是内部运动的配分函数, (不过核配分函数在大部分情况下可以约掉): P P h N P m k T N k TQ h PN m k T N k TQ N Q Q N Q A i B A B i i i i B i i t i i i i 3 in( ) 3/ 2 3 in( ) 3/ 2 ( ) in( ) (2 ) (2 ) Qin Qr Qv Qe Qn 令: 3 3/ 2 3 3/ 2 (2 ) (2 ) h mk T V h P mk T N k T Q B A B B t 则: i t(i) in (i) A i i i Q Q Q P P N Q N Q 标准配分函数
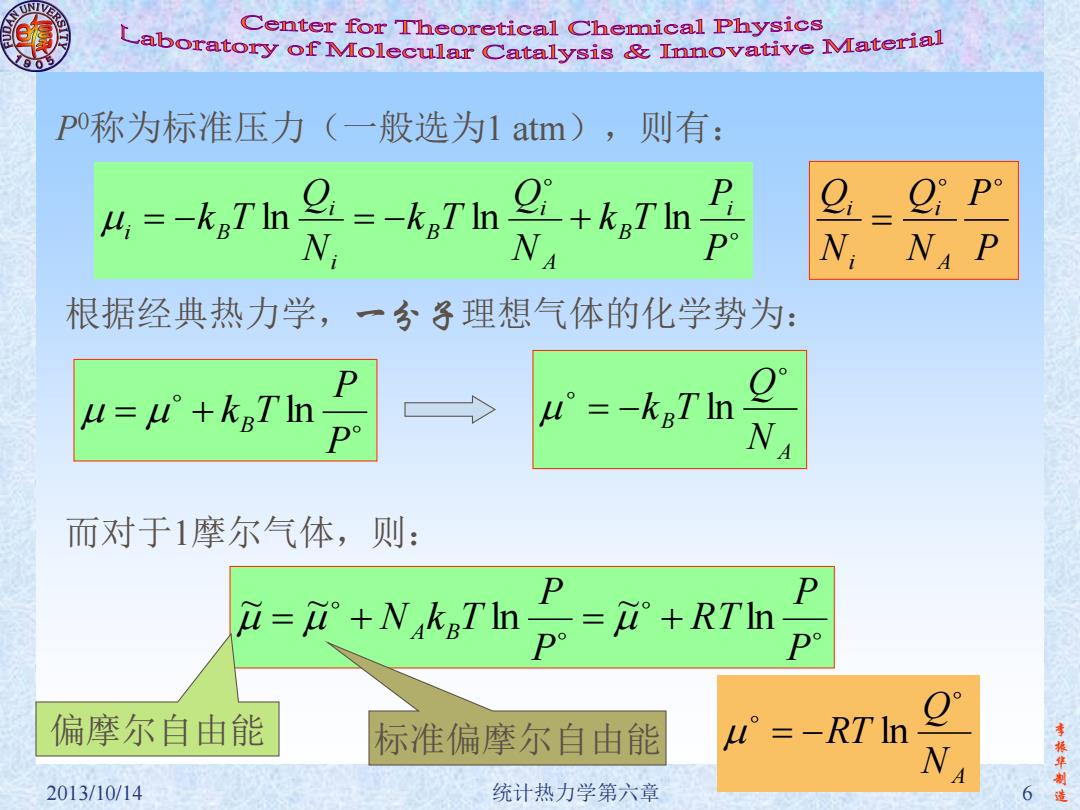
Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis&mnovative Material p称为标准压力(一般选为1atm),则有: 从=kn号-7h87n号 op N, N NA P 根据经典热力学,一分子理想气体的化学势为: u=u°+kgTn w°=-kgT In N 而对于1摩尔气体,则: P P 立=+N kT'np=+RTln 偏摩尔自由能 标准偏摩尔自由能 u=-RT In NA 振华 2013/10/14 统计热力学第六章 6 造
李 振 华 制 2013/10/14 统计热力学第六章 6 造 P0称为标准压力(一般选为1 atm),则有: 根据经典热力学,一分子理想气体的化学势为: P P kB T ln P P k T N Q k T N Q k T i B A i B i i i B ln ln ln A B N Q k T ln 而对于1摩尔气体,则: P P R T P P NA kB T ln ~ ln ~ ~ 偏摩尔自由能 标准偏摩尔自由能 NA Q RT ln P P N Q N Q A i i i

Center for Theoretical Chemical Physics Laboratory of molecular Catalysis innovative material 3.化学反应平衡常数 对于化学反应: yA1+y2A2+…=VnAn+ynAn+… 或简写成: ∑y,4=0 y为化学计量系数,对反应 物取负数,产物取正数 化学平衡的条件是△G=0,或: ∑y4,=0 李振华 2013/10/14 统计热力学第六章 造
李 振 华 制 2013/10/14 统计热力学第六章 7 造 3. 化学反应平衡常数 对于化学反应: 化学平衡的条件是DG=0,或: 0 i i Ai v 0 i i i v v1 A1 v2 A2 vn An vn An 或简写成: vi为化学计量系数,对反应 物取负数,产物取正数

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis mnovative Material 代入化学势的表达式,得: nt ∑4,=0 ∑He7hg-s P u=u+keT In 1 两边同乘以Avogadro常数: Rr∑yn分=-a rTI-a 李振华 2013/10/14 统计热力学第六章 8 造
李 振 华 制 2013/10/14 统计热力学第六章 8 造 代入化学势的表达式,得: G P P R T v P P R T v i v i i i i i i i i ~ ln ~ ln D 两边同乘以Avogadro常数: i i i i i i i i i i v P P v k T P P v k T ln ln 0 B B 0 i i i v P P kB T ln

Center for Theoretical Chemical Physics Laboratory of molecular Catalysis Innovative material 等式右边就是反应的标准摩尔自由能变化的负值: △G°=-RT In K 所以,得到平衡常数的统计热力学公式: 李振华 2013/10/14 统计热力学第六章 造
李 振 华 制 2013/10/14 统计热力学第六章 9 造 等式右边就是反应的标准摩尔自由能变化的负值: D i v A i i A i i i i i i N Q R T N Q G v R T v ln ln ~ ~ 所以,得到平衡常数的统计热力学公式: D i v i p p i P P K G RT K ln ~ i v A i p i N Q K

Center for Theoretical Chemical Physics Laboratory of Molecular Catalysis mnovative Material 由于所研究的体系为混合物,势必要选择一共同的能量零点, 假定物质A,的最低能级在此能量零点下为0' 则有 -n8,5n Q°是以最低能级的能量为零点所计算的标准配分函数,而△E° 的物理意义则是0K时反应的能量变化(以Joule/mol为单位) 振华 2013/10/14 统计热力学第六章 10 造
李 振 华 制 2013/10/14 统计热力学第六章 10 造 由于所研究的体系为混合物,势必要选择一共同的能量零点, 假定物质Ai的最低能级在此能量零点下为ε0(i),则有 Qi o是以最低能级的能量为零点所计算的标准配分函数,而DE0 o 的物理意义则是0K时反应的能量变化(以Joule/mol为单位)。 D i v A E R T i i v A i v k T i v A k T i p i i B i i i i i B N Q e N Q e N Q e K / / / 0 0( ) 0( )