微格教学教案 学院:化学化工学院 时间:10分钟 返回 科目:高中化学 课目:原电池 主讲人:王燕 训练技能:结束技能 教学目标: 教师教学行为 体现教学学生活动教学 行为的要 行为 用具 /min 1 通过前两节课的学习,现在我们来一起归纳总教师提问, 结一下。请同学们看这张挂图,这张挂图的内 引导学生 积极思考 板书 容就是我们所学的全部知识。首先我们来 回忆.巩固 下黑板上的这个装置图。同学知道这是什 己学知识 同答间颗 么装置图吗? 1.5 对,那原电池是怎样定义的呢?通过它的概念 我们是否可以得出它的实质, 提问 回答 填表 2.0 同学们知道在这个装置图中ZnCu和CuSO 溶液分别是做什么用的? 提问 回答 板书 3.0 很好,从这个装置图我们来一起回忆一下构成 原电池的条件:首先其次,然后. 提问 思考 填表 最后 在这里我要强调的是第4点,它即是原电池的 引导 回答 构成条件,又是原电池的构成前提,所以上格应 填. 既然原电池能自发的发生氧化还原反应那公 黑板上这个原电池的自发反应应该怎么写? 提问 回答 板书 4.0 他写的对不对,好,我们来继续看这个装置图,乙 板和Cu板哪个作正极那个作负极? 提问 回答 板书 4.5 对,同学们是怎样判断的,它有什么依据吗? 提问 回答 5.0 我们都知道和都具有还原性,但哪个还原性较 提问 回答 5.5 对既然Z的还原性强它又作了负极我们是 否可以得出:负极是由一些还原性较强的材料 讲解 填表 构成相应的正极弱 6.0 好,我们再来看,这个原电池的构成条件都已具 备,那么它的电极反应应该怎么写? 提向 6.5 他写的对不对我们来一起看负极是Z失去 2e,发生什么反应正极是Cu得到2e 提问 回答 填表 发生什么反应?好我们来一起填表 7.0 那这个原电池的总反应式应该怎么写 提何 回答 板书 7.5 通过总反应式的书写,我们是否可以得出它与电 极反应之间的关系 提问 回答 填表
微格教学教案 学院:化学化工学院 时间:10 分钟 返回 科目: 高中化学 课目:原电池 主讲人:王燕 训练技能:结束技能 教学目标: 时 间 分 配 /min 教师教学行为 体现教学 行为的要 素 学生活动 行为 教 学 用具 1 通过前两节课的学习,现在我们来一起归纳总 结一下。请同学们看这张挂图,这张挂图的内 容就是我们所学的全部知识。首先我们来一起 看一下黑板上的这个装置图。同学知道这是什 么装置图吗? 教师提问, 引导学生 回忆. 巩固 已学知识 积极思考 回答问题 板书 1.5 对,那原电池是怎样定义的呢?通过它的概念 我们是否可以得出它的实质, 提问 回答 填表 2.0 同学们知道在这个装置图中 Zn,Cu 和 CuSO4 溶液分别是做什么用的? 提问 回答 板书 3.0 很好,从这个装置图我们来一起回忆一下构成 原电池的条件:首先.,其次.,然后., 最后. 在这里我要强调的是第 4 点,它即是原电池的 构成条件,又是原电池的构成前提,所以上格应 填. 提问 引导 思考 回答 填表 3.5 既然原电池能自发的发生氧化还原反应,那么 黑板上这个原电池的自发反应应该怎么写? 提问 回答 板书 4.0 他写的对不对,好,我们来继续看这个装置图,Zn 板和 Cu 板哪个作正极哪个作负极? 提问 回答 板书 4.5 对,同学们是怎样判断的,它有什么依据吗? 提问 回答 5.0 我们都知道和都具有还原性,但哪个还原性较 强? 提问 回答 5.5 对,既然 Zn 的还原性强,它又作了负极,我们是 否可以得出:负极是由一些还原性较强的材料 构成,相应的正极.弱. 讲解 填表 6.0 好,我们再来看,这个原电池的构成条件都已具 备,那么它的电极反应应该怎么写? 提问 6.5 他写的对不对,我们来一起看,负极是 Zn 失去 2e ,发生什么反应,正极是 Cu 得到 2e , 发生什么反应?好,我们来一起填表. 提问 回答 填表 7.0 那这个原电池的总反应式应该怎么写 提问 回答 板书 7.5 通过总反应式的书写,我们是否可以得出它与电 极反应之间的关系 提问 回答 填表
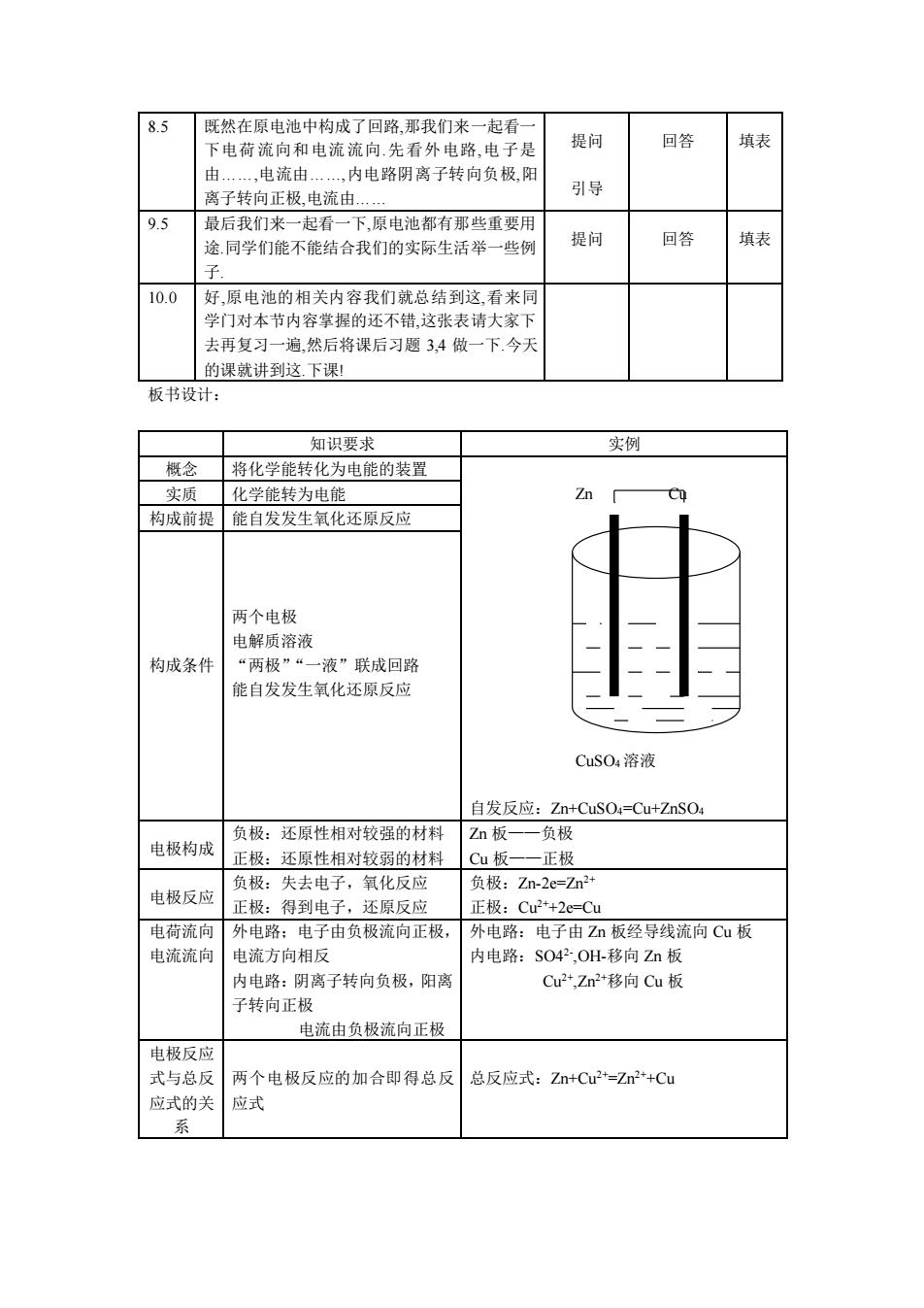
8.5 再姚在原申油中构成了回路那我们来一起看一 下电荷流向和电流流向先看外电路,电子是 提问 回答 填表 ,电流由 ,内电路阴离子转向负极阳 离子转向正极电流由. 引导 9.5 最后我们来一起看一下,原电池都有那些重要用 途.同学们能不能结合我们的实际生活举一些例 提问 回答 填表 10.0 好,原电池的相关内容我们就总结到这,看来同 学门对本节内容掌握的还不错,这张表请大家下 去再复习一遍,然后将课后习题3,4做一下今天 的课就讲到这.下课! 板书设计: 知识要求 实例 今 将化学能转化为电能的装置 实质化学能转为电能 n 构成前提能自发发生氧化还原反应 两个电极 电解质溶液 构成条件 “两极”“一液”联成回路 能自发发生氧化还原反应 CuSO,溶液 自发反应:Zn+CuSO4=Cu+ZnSO4 负极。还厦性相对时较品的材料 Zn板一一负极 电极构成正极:还原性相对较弱的材料 C板一一正极 负极:失去电子,氧化反应 电极反应 负极 Zn-2e=Zn2 正极:得到电子,还原反应 正极:Cu2+2e=Cu 电荷流向外电路:电子由负极流向正极, 外电路:电子由Z小板经导线流向Cu板 电流流向 申流方向相反 内电路:S042,OH-移向Zn板 内电路:阴离子转向负极,阳离 Cu2,Zm2*移向Cu板 子转向 电流由负极流向正极 电极反应 式与总反 两个电极反应的加合即得总反 总反应式:Zn+Cu2=Zr2*+Cu 应式的关 应式 系
8.5 既然在原电池中构成了回路,那我们来一起看一 下电荷流向和电流流向.先看外电路,电子是 由.,电流由.,内电路阴离子转向负极,阳 离子转向正极,电流由. 提问 引导 回答 填表 9.5 最后我们来一起看一下,原电池都有那些重要用 途.同学们能不能结合我们的实际生活举一些例 子. 提问 回答 填表 10.0 好,原电池的相关内容我们就总结到这,看来同 学门对本节内容掌握的还不错,这张表请大家下 去再复习一遍,然后将课后习题 3,4 做一下.今天 的课就讲到这.下课! 板书设计: 知识要求 实例 概念 将化学能转化为电能的装置 Zn Cu CuSO4 溶液 自发反应:Zn+CuSO4=Cu+ZnSO4 实质 化学能转为电能 构成前提 能自发发生氧化还原反应 构成条件 两个电极 电解质溶液 “两极”“一液”联成回路 能自发发生氧化还原反应 电极构成 负极:还原性相对较强的材料 正极:还原性相对较弱的材料 Zn 板——负极 Cu 板——正极 电极反应 负极:失去电子,氧化反应 正极:得到电子,还原反应 负极:Zn-2e=Zn2+ 正极:Cu2++2e=Cu 电荷流向 电流流向 外电路;电子由负极流向正极, 电流方向相反 内电路:阴离子转向负极,阳离 子转向正极 电流由负极流向正极 外电路:电子由 Zn 板经导线流向 Cu 板 内电路:SO42- ,OH-移向 Zn 板 Cu2+,Zn2+移向 Cu 板 电极反应 式与总反 应式的关 系 两个电极反应的加合即得总反 应式 总反应式:Zn+Cu2+=Zn2++Cu

制作电池 制作干电池 防止金尾被腐他 F与Cu相连接处于电解质溶液中Cu受保 重要应用 提高化学反应速率 用粗Zn代替纯Zn制取h,反应速率快
重要应用 制作电池 防止金属被腐蚀 提高化学反应速率 制作干电池 Fe 与 Cu 相连接处于电解质溶液中 Cu 受保 护 用粗 Zn 代替纯 Zn 制取 H 2 ,反应速率快